Nenasýtené uhľovodíky
- 2449
- 768
- JUDr. Rudolf Čapkovič
Vysvetľujeme, čo sú nenasýtené uhľovodíky, ich klasifikácia, vlastnosti, nomenklatúra a uvádzame niekoľko príkladov
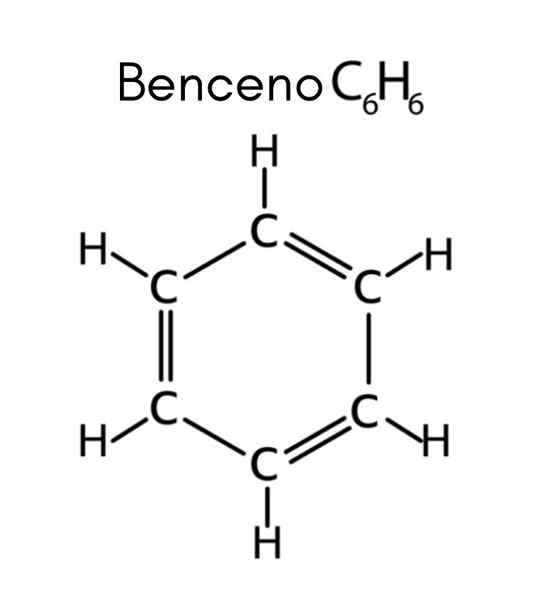
 Benzén je príkladom nenasýteného uhľovodíka
Benzén je príkladom nenasýteného uhľovodíka Čo sú nenasýtené uhľovodíky?
Ten nenasýtené uhľovodíky Sú to organické zlúčeniny, ktoré sú tvorené iba uhlíkom a vodíkom, ktoré majú jednu alebo viac viacerých väzieb medzi atómami uhlíka. To znamená, že akákoľvek zlúčenina vzorec CXHa ktoré predstavujú dvojitú alebo trojnásobnú väzbu, je nenasýtený uhľovodík.
Nenasýtené uhľovodíky sa tvoria alkénmi a alkínmi, ako aj aromatickými zlúčeninami. Dôvod, prečo sú nenasýtení, je ten, že majú menší počet vodíkov, ako by mohli mať maximum, vzhľadom na počet atómov uhlíka v štruktúre.
Nenasýtené uhľovodíky sa rozpoznávajú tým, že majú menej ako 2n+2 vodíny (čo je maximálny počet hydrogénov, ktoré môžu byť uhlíkom), kde N je počet atómov uhlíka v molekulárnom receptúre.
Príkladom nenasýteného uhľovodíka je buteno, ktorého molekulárny vzorec je C4H8. Maximálny počet hydrogénov pre 4 uhlíky by bol 2 (4) +2 = 10 hydrogény. To zodpovedá počtu hydrogénov nasýteného uhľovodíka. Pretože buteno má iba 8 vodíkov, čo je menej ako 10, potom je to nenasýtený uhľovodík.
Počet nenasýtení
Nenasýtené uhľovodíky sa vyznačujú počtom nenasýtení. To naznačuje, že počet párov vodíka menší ako nenasýtený uhľovodík sa porovnáva so nasýteným, ktorý má rovnaký počet uhlíkov.
Počet nenasýtení sa dá vypočítať pre akúkoľvek nenasýtenú zlúčeninu pomocou nasledujúceho vzorca:
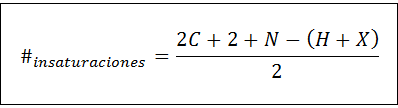
Kde C, N, H a X predstavujú počet uhlíkov, dusitanov, vodíkov a halogénov v molekulárnom receptúre. Toto číslo nám dáva predstavu o tom, koľko štvorhry alebo trojitých väzieb má zlúčeninu, vzhľadom na jeho molekulárny vzorec, hoci sa musí venovať starostlivosť, pretože cykly (ktoré nie sú nenasýtení) tiež prispievajú k počtu nenasýtení:

Príklad
Benzén má vzorec C6H6, Takže počet nenasýtení je:
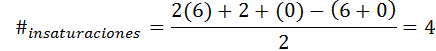
V tomto prípade 4 nezasýštenie zodpovedajú trom dvojitým odkazom a cyklu.
Klasifikácia nenasýtených uhľovodíkov
Podľa typu uhľovodíka
- Alkénovia: Sú to tí, ktorí majú v štruktúre aspoň jedno dvojité spojenie.
- Alkynes: Sú to tí, ktorí majú vo svojej štruktúre aspoň jeden trojitý odkaz.
- Aromatické: Sú to cyklické polynenasýtené zlúčeniny so špeciálnymi vlastnosťami, vďaka ktorým sú obzvlášť stabilné.
Podľa uhlíkového reťazca
- Lineárne: nenasýtené zlúčeniny, v ktorých sú všetky atómy uhlíka navzájom spojené v jednom reťazci.
- Rimated: Sú to tie, ktoré majú hlavný reťazec a tiež niekoľko bočných reťazcov, ktoré tvoria dôsledky.
- Cyklické: Sú to tie, v ktorých je prezentovaný uzavretý cyklus atómov uhlíka, v ktorom je prezentovaný aspoň jedna dvojitá alebo trojitá väzba (cykloalquenos, cykloalkíny a aromatické).
Podľa počtu nenasýtení
- Mononenasýtené: Ak majú iba viacnásobný odkaz, to znamená, je to jediný dvojitý zväzok alebo jediný trojitý odkaz.
- Polynasturované: Ak má štruktúra viac ako jedno viacnásobné spojenie, ako v prípade alkán, alkán, alkeníny atď.
Vlastnosti nenasýtených uhľovodíkov
Vlastnosti nenasýtených uhľovodíkov silne závisia od konkrétneho typu príslušného uhľovodíka:
Fúzne a varné body
Všeobecne majú nenasýtené uhľovodíky nízke fúzne a varné body. Avšak v porovnaní s alkanmi majú alkény s rovnakým počtom uhlíkov a podobného hlavného reťazca zvyčajne nižší bod varu, zatiaľ čo alkiny majú tendenciu mať väčšie body varu.
To isté platí pre fúzne body. V nasledujúcej tabuľke je zrejmé, že bod fúzie aj varu 1-penténu sú nižšie ako tie, ktoré sú v Pentane, a to, ktoré sú uvedené 1-Pentino.

Fyzický stav
Vďaka svojim nízkym roztaveniam a bodom varu majú nenasýtené uhľovodíky s nízkou molekulovou hmotnosťou tendenciu byť plynné pri teplote miestnosti. Mnohé z nich sú tiež kvapalné a látky s väčšou molekulovou hmotnosťou sú pevné. V mnohých prípadoch sú tuhé látky amorfné tuhé látky namiesto kryštalických.
Polarita
Všetky uhľovodíky, vrátane nenasýtených, sú apolárne zlúčeniny, pretože uhlíková elektronegativita a vodík sú veľmi podobné. Jedinou výnimkou je v prípade terminálnych alkinov2 a SP3.
Rozpustnosť
Byť apolárny, nenasýtené uhľovodíky sú nerozpustné vo vode a iných polárnych rozpúšťadlách, ale sú veľmi rozpustné v apolárnych rozpúšťadlách, ako je tetrachlorid uhlíka, cyklohexan a ďalšie. V skutočnosti sú mnohé z týchto zlúčenín samy osebe apolárne rozpúšťadlá.
Môže vám slúžiť: Disposio: Štruktúra, vlastnosti, získanie, použitieSú to palivá
Charakteristikou všetkých uhľovodíkov, vrátane nenasýtených, spočíva v tom, že horia v prítomnosti kyslíka, aby sa stali oxidom uhličitým a energiou na uvoľňovanie vody vo forme svetla a tepla.
Môžu polymerizovať
Prostredníctvom rôznych chemických reakcií sa alkény a alkíny môžu navzájom spojiť, aby vytvorili polyméry ako v prípade polyetylénu a polypropylénu, aby sme spomenuli iba niektoré. Takže nenasýtené uhľovodíky sú východiskovým materiálom mnohých bežných plastov.
Chemická reaktivita
Reaktivita silne závisí od typu funkčnej skupiny, ktorá má molekulu. V prípade alkénov a alkínov sú zvyčajne celkom reaktívne a môžu trpieť reakciami hydrogenácie, hydratácie, hydrohalogenácie a iných typov pridaných reakcií.
Na druhej strane, aromatické zlúčeniny sú zvyčajne dosť inertné, pretože sú veľmi stabilné. Charakteristické reakcie týchto zlúčenín sú aromatické elektrofilné substitučné reakcie.
Nomenklatúra nenasýtených uhľovodíkov
Nomenklatúra alkénov
Lineárne alkény
Názov lineárnych alkénov je postavený umiestnením predpony, ktorá označuje počet atómov uhlíka v reťazci, po ktorom nasleduje lokalizácia uhlíka, kde samostatná dvojitá väzba začína skriptmi od zvyšku mena a dokončená príponou _eno:
Predpona
- Príklad:
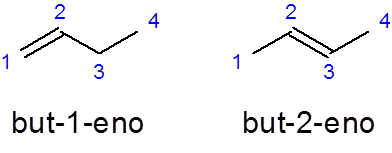
On Ale -1 -No Je to názov lineárneho butenu s dvojitou väzbou v prvom uhlíku, zatiaľ čo Ale-2-deväť Má dvojitú väzbu v druhom uhlíku.
Rozvetvené alkény
V prípade rozvetvených alkénov sa prvýkrát vyberie najdlhší hlavný reťazec obsahujúci oba uhlíky s dvojitým dlhopisom a priorita dvojitého dlhopisu je očíslovaná. Názov je postavený ako prvé umiestnením dôsledkov do abecedného poradia predchádzajúci.
- Príklad:
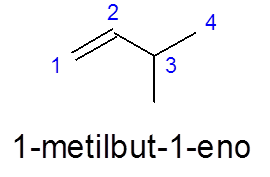
V 3-metylbute-1 -e sa číslovanie vykonáva zľava doprava, aby sa prednosť dvojitému väzbe namiesto toho, aby uprednostnila vetvenie (metylová skupina).
Polyény
V prípade polynenasýtených alebo polokrénových alkénov, ktoré obsahujú viac ako jednu dvojitú väzbu, sa ako hlavný reťazec vybral najväčší možný počet dvojitých väzieb, bez ohľadu na to, či existujú ďalšie dlhšie reťazce.
V mene hlavného reťazca sa pridá lokalizácia pre každú dvojitú väzbu a predponu DI, Tri, Tetra atď. Pred ukončením.
- Príklad:
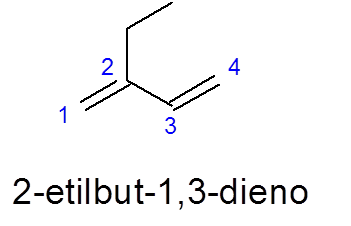
V tomto prípade si všimnite, že napriek skutočnosti, že existuje dlhší 5 -karbonový reťazec, vyberie sa 4 zo 4, pretože obsahuje dve dvojité odkazy.
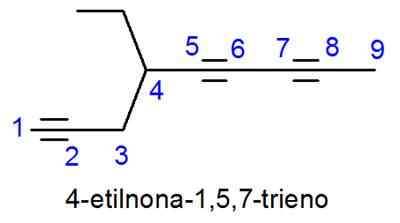
Nomenklatúra Alquinos
Alkynes sú pomenované veľmi podobné alkéniám, s jediným rozdielom, že názov končí v -ino namiesto -eno. V prípadoch, keď existuje viac ako jeden trojitý odkaz, sú umiestnené lokalizácie všetkých a číselnú predponu, ktorá naznačuje, koľko ich je.
- Príklad:
Nomenklatúra aromatických zlúčenín
Aromatické uhľovodíky sú vymenované za deriváty benzénu a číslovanie a spôsob ich pomenovania závisí od toho, koľko substituentov má prsteň.
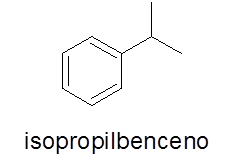
Aromatické krúžky s jedným substituentom
V takom prípade to nie je potrebné. Názov pozostáva z mena pobočky, po ktorom nasleduje slovo benzén.
- Príklad:
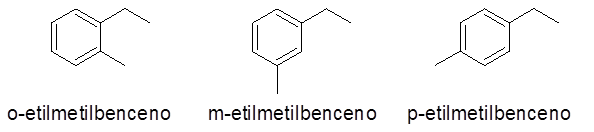
Aromatické krúžky s dvoma substituentmi
V tomto prípade je možné uviesť 3 čísla alebo výmenné vzorce (1.2), (1.3) a (1,4). Pretože je ľahostajné naznačovať, ktorá náhrada je v uhlíku 1 a ktorá v druhom, orto predpony (O-), meta- (m-) a para- (p-).
- Príklady:
Aromatické krúžky s viac ako 2 substituentmi
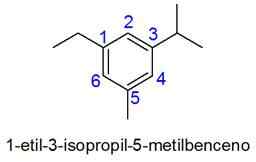
V tomto prípade sa vyberie číslovanie najmenšej kombinácie lokalizátorov. Ak sú dve čísla rovnaké, prioritou sa podáva substituentom podľa abecedného poradia.
- Príklady:
Príklady nenasýtených uhľovodíkov
Ďalej sú uvedené ďalšie príklady nenasýtených uhľovodíkov.
Acetylén (c2H2)
Acetylén je spoločným názvom etina, najjednoduchšieho alchemínu. Táto zlúčenina má 2 nenasýtenie kvôli svojmu trojitým spojením a používa sa okrem iného v oceľovom a zváracom zariadení.
Cyklohexen (c6H10)
6 -karbonový cyklický alkén, ktorý má dve nenasýtenie: jeden v dôsledku cyklu a druhý kvôli dvojitej väzbe.
Natiahnutie (c8H8)
Táto zlúčenina sa bežne používa pri príprave polymérov. Je to aromatický alkén s 5 nenasýtením.

