Hydrazínová štruktúra, vlastnosti, syntéza, použitie

- 1209
- 333
- Denis Škriniar
Ten Hydrazín Je to anorganická zlúčenina, ktorej chemický vzorec je n2H4. Skladá sa z člena rodiny dusíkových hydrorov, čo je najjednoduchšie. Aj keď sa jej molekula javí jednoduchosť, vykazuje niekoľko chemických a fyzikálnych vlastností, vďaka ktorým je hydrazín zaujímavou a energeticky sľubnou látkou.
Udržujte úzku podobnosť s vodou, pretože obe existujú ako kvapalné látky v podobných intervaloch teploty. Z hydrazínu môžeme získať organické deriváty nahradením svojich hydrogénov sýtenými skupinami. Z IT syntetizovaných hydrazónov, hydrazidov a hydrazínových solí.
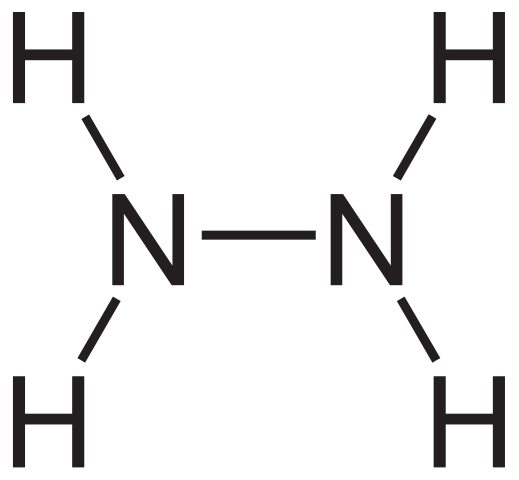 Hydrazínové štrukturálne vzorec. Zdroj: Neurotoger cez Wikipedia.
Hydrazínové štrukturálne vzorec. Zdroj: Neurotoger cez Wikipedia. Štrukturálny vzorec hydrazínu je uvedený vyššie, ktorý je možné písať ako H2Nnh2 alebo h2N-nh2. Ak sa pozriete opatrne, zdá sa, že dve molekuly NH3 Mali by sa navzájom prepojiť. Pri tvorbe prepojenia N-N však sú zapojené nielen molekuly amoniaku.
Hydrazín je zlúčenina, ktorá má viac aplikácií, pretože je vynikajúcim prekurzorom pre symfíny zlúčenín, organických aj anorganických. Podobne vďaka svojej redukčnej sile a výrobkom rozkladu je určený na odstránenie kyslíka a iných plynov, získať drahé kovy; A najmä na zvýšenie kozmickej lode a stavu -of -Art lietadlá.
[TOC]
Hydracín
Molekula a prepojenie
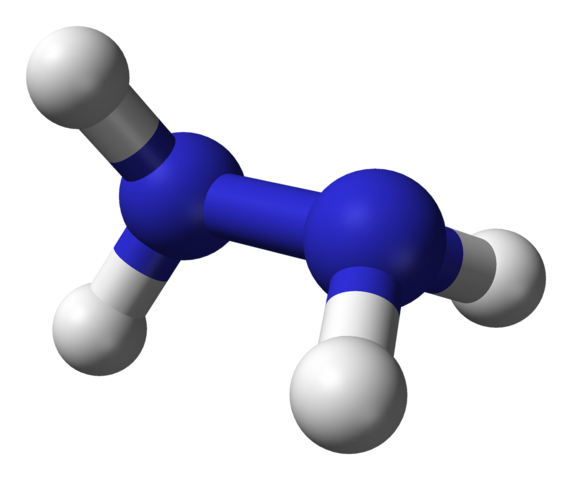 Molekulárna štruktúra hydrazínu. Zdroj: Ben Mills Via Wikipedia.
Molekulárna štruktúra hydrazínu. Zdroj: Ben Mills Via Wikipedia. Na hornom obrázku máme hydrazínovú molekulu predstavovanú s guľovými a stĺpcovými modelmi. Všimnite si, že priestorová orientácia atómov vodíka, biele gule, kontrastuje s dojmom, ktorý ponúka štrukturálny vzorec; to znamená, že vodíny oboch -nh2 Nie sú zarovnané alebo zatmené, ale majú navzájom uhol rotácie 95 °.
V skutočnosti je to natoľko, že Link N-N je sotva schopný otáčať sa a má energetickú bariéru, ktorú je potrebné vypršať na zatienenie štyroch atómov vodíka.
O čom to je? V zásade do silných elektronických odporov, ktoré sa vzájomne zažívajú dva páry solitárnych elektrónov na atómoch dusíka. Tento 95 ° uhol je ten, ktorý dáva molekule hydrazínu najväčšiu stabilitu.
Môže vám slúžiť: lítiumbromid: Štruktúra, vlastnosti, použitie, rizikáGeometria
Každý atóm dusíka má hybridizáciu SP3, Prijatie trojuholníkovej pyramídovej geometrie. Preto s pármi voľných elektrónov by sa mohla vizualizovať molekula hydracínu, ako sú dve pyramídy spojené s jedným z jeho vrcholov, a v ktorých centrách by sa atómy dusíka umiestnili.
Intermolekulárne interakcie
Vzorec H2Nnh2 Mohol by som dať falošnú predstavu, že hydrazín je apolárna zlúčenina pre spojenie dvoch rovnakých skupín. Avšak molekulárna štruktúra a jej otočená väzba N-N ukazujú, že molekula nie je úplne symetrická, tiež uvádza, že ich voľné páry elektrónov neosmerujú vopredové smery.
To znamená, že hydrazín, ktorý je štrukturálne a elektronicky asymetrický, predstavuje dipólový moment. A preto ich molekuly vzájomne interagujú prostredníctvom dipólu-dipol2Nnh2-NH2NH2, ktoré sú zodpovedné za to, že hydrazín má veľmi vysoký bod varu.
Hydracín
 Hydratovať hydrazín. Zdroj: LHCHEM/CC BY-SA (https: // creativeCommons.Org/licencie/By-SA/3.0)
Hydratovať hydrazín. Zdroj: LHCHEM/CC BY-SA (https: // creativeCommons.Org/licencie/By-SA/3.0) Fyzický vzhľad
Hydrazín je bezfarebná kvapalina podobná vode, pokiaľ ide o viskozitu a hustotu. Keď ho spáli, emituje biele pary, okrem získania amoniaku a rýb.
Molárna hmota
32.0452 g/mol
Bod topenia
2 ° C.
Bod varu
114 ° C. Všimnite si, že hydrazín existuje v kvapalnom stave v teplotnom intervale 2-114 ° C, veľmi podobný vode, 0-100 ° C.
Hustota
1.021 g/cm3
Hustota pary
1.1 vo vzťahu vzduchu.
Tlak vodnej pary
Okolo 0.010 bankomat o 30.7 ° C
Rozpustnosť
Hydrazín je miešateľný s vodou, ako aj s niekoľkými primárnymi alkoholmi. Hydrazín tvorí hydrát s vodou, n2H4· H2Alebo, čo sa vyznačuje hustejším ako čistý alebo bezvodý hydrazín. Tento hydrát je najviac predávaným produktom, pretože je stabilnejší a lacnejší.
Dipolárny moment
1.85 D. Je to skôr polárna látka, takmer rovnaká ako voda.
Môže vám slúžiť: kyselina yodná (HIO3): Štruktúra, vlastnosti, riziká a použitiaHrebeň
0.876 cp
Bod vzplanutia
52 ° C
Teplota
Líši sa v závislosti od látok alebo povrchov, s ktorými prichádza do kontaktu. Napríklad pri oxidoch železa horí pri 23 ° C, zatiaľ čo na skle alebo iných nádobách sa nezačína zapáliť až do 270 ° C.
Rozklad
Keď horí vo vzduchu, rozkladá sa v oxidoch dusíka, nieX. Ale pokiaľ ide o jeho katalytický rozklad, to znamená, že sa zrýchľuje oxidmi kovov alebo kovmi, získajú sa produkty ako amoniak, dusík a vodík a obrovské množstvo tepla, ktoré nakoniec vytvoria horiacu, ale neviditeľnú plameň.
Reaktivita
Hydrazín je dobrým redukčným činidlom, pretože keď oxidovaný produkuje vodu a dusík, obidve zlúčeniny, ktoré netrpia sekundárne reakcie.
Na druhej strane, hydrazín je nukleofil, pretože na pripojenie k iným organickým molekulám používa svoje voľné páry elektrónov. Podobne môže utrpieť nahradenie3, Na výrobu metylovaných derivátov: ch3Nhnh2 alebo (ch3)2Nnh2.
Reaguje so silnými kyselinami za vzniku hidrazinio soli, n2H5X a od Hidrazonia, n2H6X2. Posledne menované sú najmenej bežné. Hydrazínium síran, [n2H5] HSO4, Pripravuje sa reagovaním hydrazínovej hydrát s kyselinou sírovou.
Základnosť
Hydrazín je slabšia základňa ako amoniak:
N2H4(Ac) + h2Alebo (l) ⇌ n2H5+(Ac) + OH-(Ac)
Klimatizovaťb = 1.3 · 10-6
Je to preto, že kyselina hydrazinio konjugát2H5+ alebo h3N+-NH2, má svoje zaťaženie destabilizované atraktorovým účinkom skupiny NH2; to znamená namiesto poskytovania elektronickej hustoty pozitívnemu dusíku, stiahnutie.
Hydrazín je schopný trpieť druhou, oveľa menej pravdepodobnou protonáciou, ktorá vytvára ešte nestabilnejšiu konjugovanú kyselinu:
N2H5+(Ac) + h2Alebo (l) ⇌ n2H6+(Ac) + OH-(Ac)
Klimatizovaťb = 8.4 · 10-16
Hydrazónia, n2H6+ alebo h3N+-N+H3, Je veľmi nestabilný kvôli odporom medzi pozitívnym zaťažením oboch atómov dusíka. Avšak v spoločnosti určitých aniónov môže existovať ako soľ.
Toxicita
Hydrazín anhydra je mimoriadne toxická, žieravá a možno karcinogénna látka, nehovoriac o tom, že je veľmi výbušná, takže by mala byť manipulovaná iba v rámci prísnych bezpečnostných protokolov.
Môže vám slúžiť: Faktor stlačiteľnosti: Ako vypočítať, príklady a cvičeniaSyntéza
Najpoužívanejšou metódou na syntézu hydrazínu je proces Raschig. Pozostáva z nasledujúcich dvoch reakcií:
NH3(ac) + naocl (ac) → nh2Cl (ac) + NaOH (ac)
2nh3(Ac) + nh2Cl (ac) → n2H4(Ac) + nh4Cl (ac)
Nakoniec sa vytvorí hydrát n2H4· H2Alebo, ktorý je destilovaný v prítomnosti KOH alebo NaOH ako suchých tuhých látok:
N2H4· H2O → n2H4
Týmto spôsobom sa získa anhydra hydrazín a vytvorí sa N-N Link.
Hydrazín používa
 Hydrazín je jednou z najviac ocenených látok v leteckom rozmachu. Zdroj: pxhere.
Hydrazín je jednou z najviac ocenených látok v leteckom rozmachu. Zdroj: pxhere. - Hydrazín v prítomnosti kovových katalyzátorov sa exotermicky rozkladá, aby sa vytvoril dusík a vodík, čím poskytuje dostatok energie na zvýšenie lietadiel, rakiet a satelitov.
- Táto tendencia rozkladať sa a spôsobovať plyny sa používa presne na nafúknutie polymérnych materiálov, ako je guma alebo polyetylén, a ich premena na svoje príslušné peny.
- Podobne uvoľnením plynov môžu tlačiť ostatných, ktoré sú rozpustené v potrubiach z potrubí, takže je veľmi užitočné eliminovať kyslík z kotlov, čím sa vyhýbajú, že korodujú, že korodujú.
- Hydrazín je prekurzorový materiál pre mnoho organických zlúčenín s farmakologickými funkciami, antifungicídmi, herbicídmi, insekticídmi, hnojivami atď. Je to kvôli tomu, že sú syntetizované široká škála cyklických derivátov dusíka.
- Nakoniec sa na zníženie drahých kovových minerálov používajú dobré redukčné činidlo, hydrazín a jeho hydrazíniové soli sa v metalurgickom priemysle dostanú veľkú hodnotu.
Odkazy
- Triasť a Atkins. (2008). Anorganická chémia. (Štvrté vydanie). MC Graw Hill.
- Wikipedia. (2020). Hydrazín. Zdroj: In.Wikipedia.orgán
- Národné centrum pre biotechnologické informácie. (2020). Hydrazín. Pubchem Comunund Zhrnutie pre CID 9321. Získané z: pubchem.Ncbi.NLM.NIH.Vláda
- Redaktori Enyclopaedia Britannica. (2020). Hydrazín. Encyclopaedia Britannica. Získané z: Britannica.com
- Iridium Ďalej. (20. júna 2017). Hydrazín - toxický pre ľudí, ale satelity to milujú. Získané z: Iridia.com

