Štruktúry šesťhranných látok, funkcie, formy
- 4470
- 1361
- Alfréd Blaho
Ten Šesťheskáza (HK) je enzým, ktorý katalyzuje prvú reakciu glykolytickej cesty prakticky vo všetkých živých organizmoch, a to v prokaryotoch aj v eukaryotoch. Je zodpovedný za prenos fosforylovej skupiny na glukózu, ktorá produkuje glukózu-6p, hoci môže tiež fosforylovať ďalšie hexózne cukry (zo 6 atómov uhlíka).
Tento enzým je klasifikovaný do jednej z dvoch rodín enzýmov glukózy -kinázy (enzýmy, ktoré prenášajú fosforylové skupiny na substráty, ako je glukóza): Hexoquinázová rodina (HK), ktorej členovia sú rozdelení do troch rôznych skupín známych ako skupina HK, skupina HK, skupina HK, skupina HK, skupina HK, skupina HK Skupina A a skupina B.
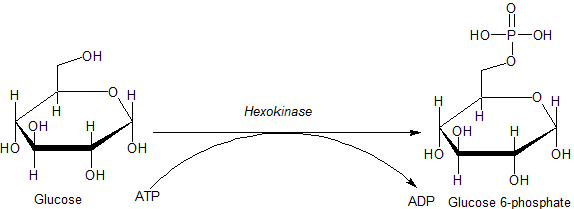
 Reakcia katalyzovaná hexoquinázovým enzýmom (zdroj: jmun7616 [verejná doména] prostredníctvom Wikimedia Commons)
Reakcia katalyzovaná hexoquinázovým enzýmom (zdroj: jmun7616 [verejná doména] prostredníctvom Wikimedia Commons) Enzýmy patriace do rodiny HK sa vyznačujú glukózovou fosforyláciou na úkor ATP ako molekula donátora fosforylovej skupiny a členovia toho istého sa navzájom líšia hlavne vzhľadom na ich molekulárnu hmotnosť a špecifickosť substrátu a špecifickosť substrátu.
Skupina HK patrí enzýmy eukaryotických organizmov (ATP: D-hexóza 6-fosfotransferázy), medzitým je reprezentovaná enzýmami gramnegatívnych baktérií, cyanobaktérií, amitodriedovaných a tripanozomatidných protistov a skupinou B obsahuje enzmy gram -pozitívne baktérie a organizmy creanarqueotov.
Enzýmy skupín A a B sú známe aj ako glykoquinázy (GLCK), pretože sú schopné výlučne glukózovej fosforylácie, a preto sa tieto enzýmy nazývajú ATP: D-glukóza 6-fosfotransferáza.
Ako glykolytický enzým má hexochináza veľký metabolický význam, pretože bez nej by táto dôležitá cesta nebola možná a bunky boli vysoko závislé od spotreby uhľohydrátov, ako napríklad mozog a svalové bunky mnohých cicavcov, by mali vážne funkčné a fyziologické prekážky všeobecne.
[TOC]
Štruktúra
Ako bude vidieť neskôr, u cicavcov a iných stavovcov (ako aj v jednobunkových organizmoch, ako sú kvasinky), existujú rôzne typy hexozázových enzýmov. U cicavcov boli opísané štyri: izoformy I, II, III a IV.
Môže vám slúžiť: Zliatiny železných: Charakteristiky, typy, príkladyPrvé tri izoenzýmy majú molekulovú hmotnosť 100 kDa, ale izoenzým IV má 50 kDa. Tieto izoenzýmy (najmä I-III) vykazujú medzi nimi vysokú podobnosť sekvencie, pokiaľ ide o ich konce C- a N-terminálnych koncov, ako aj ostatných členov rodiny šesťhozelových.
N-terminálna doména týchto enzýmov sa považuje za doménu „regulátora“, zatiaľ čo katalytická aktivita sa vykonáva C-terminálnou doménou (HK II cicavcov má aktívne miesta v obidvoch doménach).
N-terminálna doména je spojená s C-terminálnou doménou prostredníctvom vrtule alfa, každá z nich má asi 50 kDa molekulovú hmotnosť a má spojenie pre glukózu.
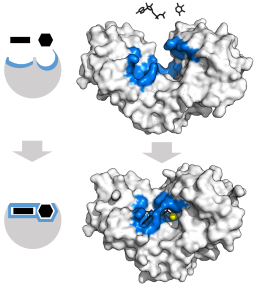 Indukovaný model úprav pre enzýme hexoquinázy (vzhľadom na jeho dva substráty: ATP a glukóza) (zdroj: Thomas Shafee [CC po 4.0 (https: // creativeCommons.Org/licencie/o/4.0)] Via Wikimedia Commons)
Indukovaný model úprav pre enzýme hexoquinázy (vzhľadom na jeho dva substráty: ATP a glukóza) (zdroj: Thomas Shafee [CC po 4.0 (https: // creativeCommons.Org/licencie/o/4.0)] Via Wikimedia Commons) Terciárna štruktúra týchto enzýmov je v podstate zložená z β umiestnených listov zmiešaných s alfa vrtulami, ktorých pomer sa líši v závislosti od enzýmu a daného druhu; Stránka Únie pre ATP, druhý hexoquinázový substrát, sa zvyčajne skladá z piatich β hárkov a dvoch vrtuľníkov alfa.
Funkcia
Hexoquináza má transcendentálnu funkciu v metabolizme uhľohydrátov väčšiny živých bytostí, pretože katalyzuje prvý krok glykolytickej cesty, sprostredkuje fosforyláciu glukózy vo vnútri.
Tento prvý krok glykolýzy, ktorá pozostáva z prenosu fosforylovej skupiny z ATP (darca) na glukózu, poskytujúca 6-fosfát a glukózu ADP, je prvým z dvoch krokov investícií do energie vo forme ATPP.
Okrem toho reakcia katalyzovaná hexoquinázou je priechod „aktivácie“ glukózy na následné spracovanie a predstavuje krok „záväzku“, pretože glukóza tak fosforylovaná nemôže opustiť bunku prostredníctvom svojich konvenčných transportérov v membránovej plazme v membránovej plazme.
Môže vám slúžiť: heterogénne zmesiProdukt reakcie katalyzovanej hexoquinázou, tj 6-fosfátovou glukózou, je bod vetvy, pretože je prvým substrátom použitým na ceste pentózového fosfátu a v syntéze glykogénu u mnohých zvierat (a škrob na rastlinách).
V rastlinách
Funkcia hexoquinázy v rastlinách sa príliš nelíši od funkcie zvierat alebo mikroorganizmov, v horných rastlinách však tento enzým tiež funguje ako „senzor“ koncentrácie cukru.
Dôležitosť tejto funkcie v týchto organizmoch súvisí s účasťou cukrov ako regulačných faktorov pri expresii génov, ktoré sú zapojené do rôznych metabolických procesov, ako napríklad:
- Fotosyntéza
- Cyklus glioxylátu
- Dýchanie
- Degradácia alebo syntéza škrobu a sacharózy
- Metabolizmus dusíka
- Obrana proti patogénom
- Regulácia bunkového cyklu
- Liečivá reakcia
- Pygmentácia
- Starnutie, okrem iného.
Táto funkcia hexoquinázy ako „senzora“ množstva intracelulárnej glukózy bola opísaná aj pre kvasinky a cicavce.
Tvary
V prírode existujú rôzne formy šesťdesiat.
Napríklad u človeka a iných zvierat stavovcov bola demonštrovaná existencia 4 rôznych izoforiem enzýmu šesťhozájky v cytosolickej kompartmente, ktorej bola označená rímskymi číslami I, II, II, III a IV.
Izoenzýmy, II a III sú molekulová hmotnosť 100 kDa, sú inhibované svojím reakčným produktom (6-fosfát glukóza) a veľmi súvisia s glukózou, to znamená, že majú veľmi nízku KM konštantnú konštantu. Tieto enzýmy však majú malú špecifickosť substrátu, ktoré sú schopné fosforylovať ďalšie hexózy, ako je fruktóza a ruka.
Môže vám slúžiť: kyseliny: Charakteristiky a príkladyIzoenzým IV, známy tiež ako glykoquináza (GLCK), má iba 50 kDa molekulovú hmotnosť a napriek tomu, že je málo príbuzných (vysoké hodnoty KM), má vysokú špecifickosť glukózy ako substrát a nepodlieha im regulačné mechanizmy, že ostatné mechanizmy, ktoré ostatné tri izoenzýmy.
Glukoquináza (izoenzým IV hexoquinázy mnohých cicavcov) sa nachádza hlavne v pečeni a pomáha tomuto orgánu v „prispôsobení“ rýchlosti spotreby glukózy v reakcii na variácie tohto substrátu v cirkulujúcej krvnej krvi krvná krv.
Tri gény, ktoré kódujú hexoquinázy I, II a III u zvierat, sa zdá, že III spočívajú iba na konci C-konca C-terminálu.
Odkazy
- Aronoff, s. L., Berkowitz, K., Shreiner, b., & Chcem, L. (2004). Metabolizmus a regulácia glukózy: za inzulínom a glukagónom. Spektrum, 17(3), 183-190.
- Harrington, G. N., & Bush, D. R. (2003). Bifuncionálna úloha hexokinázy v metabolizme a glukózovej signalizácii. Rastlinná bunka, pätnásť(11), 2493-2496.
- Jang, j. C., León, P., Zhou, L., & Sheen, J. (1997). Hexokináza, pokiaľ ide o senzor cukru vo vyšších rastlinách. Rastlinná bunka, 9(1), 5-19.
- Kawai, s., Mukai, T., Mori, s., Mikami, B., & Murata, K. (2005). Hypotéza: Štruktúry, evolúcia a predchodca glukózových kináz v rodine hexokinázy. Journal of Bioscience and Bioengineering, 99(4), 320-330.
- Mathews, K. A. (1998). Dodávka. Biochémia.
- Wilson, J. A. (2003). Izozýmy cicavcov hexokinázy: štruktúra, subcelulárna lokalizácia a metabolická funkcia. Journal of Experimental Biology, 206(12), 2049-2057.

