Hexano (C6H14) Fyzikálne a chemické vlastnosti, štruktúra, použitie, toxicita
- 3107
- 466
- Valentín Dula
On hexán Je to uhľovodík, ktorý sa vyznačuje tým, že je organickou zlúčeninou, ktorej kondenzovaný chemický vzorec je C6H14. Je to bezfarebná, priehľadná kvapalina, ktorá sa nedá zmiešať s vodou. Predstavuje päť izomérov, pričom lineárny je jedným z najdôležitejších parafínových uhľovodíkov v priemysle a výskume.
Hexán sa získava frakcionovanou destiláciou ropy. Je tiež prirodzene prítomný v citrusových plodoch a prchavých frakciách rôznych rastlín alebo ovocia, ako je jablko, guava, pražené lieskové orechy, sladké zemiaky a šalvia.
 N-hexán. Zdroj: Benjah-Bmm27 [verejná doména]
N-hexán. Zdroj: Benjah-Bmm27 [verejná doména] Je to veľmi horľavá prchavá tekutina nachádzaná v benzíne, rýchlom sušení lepidla a trením cementu. Hexán sa používa ako rozpúšťadlo v procese extrakcie rastlinných olejov, ako aj lipidov a tukov prítomných v kontaminovaných vodách a pôdach.
Ľudia, ktorí sú profesionálne vystavení Hexanu, môžu pociťovať poškodenie periférneho nervového systému, ktoré sa prejavujú brnenie a nohy v nohách a rukách; Okrem generalizovanej svalovej slabosti a v závažných prípadoch atrofia kostrových svalov.
[TOC]
Fyzikálne a chemické vlastnosti hexanov
Fyzický vzhľad
Bezfarebná, priehľadná a veľmi prchavá tekutina.
Molárna hmota
86,178 g/mol
Vôňa
Podobný benzínu
Prah
1,5 ppm
Hustota
0,6606 g/ml
Bod topenia
-96 až -94 ° C
Bod varu
68,5 až 69,1 ° C
zapaľovač
-22 ° C (zatvorený šálka).
Rozpustnosť
9,5 mg/l (prakticky nemiešateľný s vodou)
Rozpustnosť v rozpúšťadlách
Veľmi rozpustný v etanole, rozpustný v etyléteru a chloroforme. Misilné s alkoholom, chloroformom a éterom.
Relatívna hustota pary so vzduchom
2,97 (vzduch = 1)
Koeficient priečneho októbra/vody
Log p = 3 764
Tlak vodnej pary
17,60 kPa pri 20 ° C
Vlnová dĺžka maximálnej optickej hustoty
200 nm
Môže vám slúžiť: niobio (nb): štruktúra, vlastnosti, použitia, získanieIndex lomu
1 375
Hrebeň
0,3 MPa · s
Kaliforka
265.2 J · K-1· Mol-1
Spaľovacie teplo
4.163,2 kJ · mol-1
Odparovanie
31,56 kJ · mol-1
Povrchové napätie
17,89 Mn/m A 25 ° C
Ionizačný potenciál
10,18 eV
Stabilita
Stajňa. Nekompatibilné s oxidačnými činidlami, chlór, fluorid, chlorória horčíka. Tvorí výbušnú zmes so vzduchom.
Reaktivita
Hexán môže rázne reagovať s oxidačnými materiálmi, ktoré môžu zahŕňať kvapalný chlór, koncentrovaný kyslík, chlórnan sodný a chlórnan vápenatý. Je tiež nezlučiteľná s dyitrogénom tetroxidu. Hexán môže zaútočiť na niektoré formy plastov, gumy a povlakov.
Hexánová štruktúra
Intermolekulárne interakcie
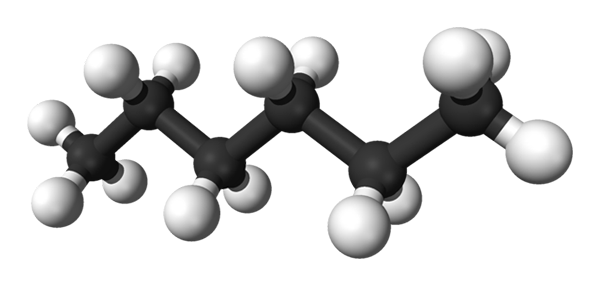
Prvý obrázok zobrazuje molekulu n-Hexán predstavovaný modelom sfér a barov. Čierne gule zodpovedajú atómom uhlíka, ktoré tvoria kľukatú uhlíkovú kostru, zatiaľ čo biele gule sú atómy vodíka. On n-Hexano je preto uhľovodíkový, lineárny a vysoko dynamický.
Pretože všetky jeho c-h odkazy sú nízkou polaritou, molekule chýba moment dipólu. Pritom jeho intermolekulárne interakcie nie sú z dipólového dipolu.
Každá molekula n-Hexano „sa hodí“ na druhej strane pri veľmi nízkych teplotách, ako by sa predpokladalo v jeho kryštalickej štruktúre. Na druhej strane, v tekutine sa ich kostry ohýbajú a otáčajú svoje väzby C-H, čo pochádza z toho, že uvedená tekutina je prchavá a vrie na 68,7 ° C.
Izoméry
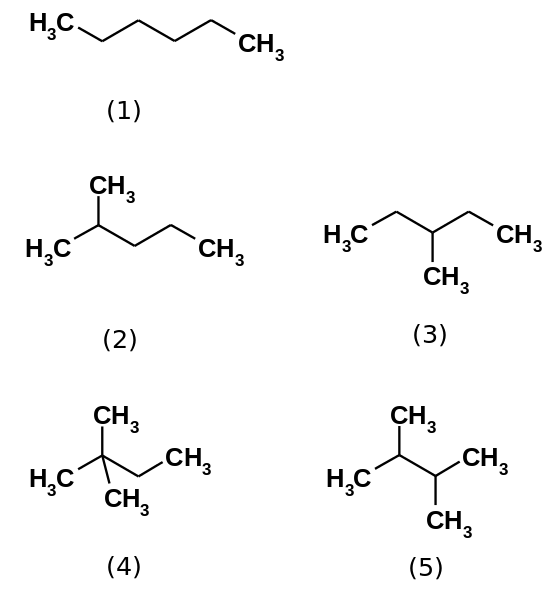 Päť hexánových izomérov. Zdroj: Steffen 962 [verejná doména]
Päť hexánových izomérov. Zdroj: Steffen 962 [verejná doména] Hexánový uhľovodík v skutočnosti pozostáva z piatich izomérov, ktoré sú n-Hexán najmenej rozvetvený, (1). Ďalšie štyri izoméry sú v rastúcom poradí:
2-metylpropán (2)
3-metylpropán (3)
2,2-dimetylbután (4)
2,3-dimetylbután (5)
Všimnite si, že štruktúry sa viac rozvetvujú od (1) do (5). Byť viac rozvetvený, disperzné sily sa znižujú, pretože už neexistujú lineárne časti, ktoré sa liečia efektívne. To vedie k zníženiu a variácii bodov varu izomérov; Aj keď sú pozorované určité prijateľné nezrovnalosti.
Môže vám slúžiť: čo je Erristeneo?Obidva 2-metylpropány. Potom nasleduje 2,3-dimetylbután (PEB = 58 ° C), aby sa konečne umiestnili 2,2-dimetylbután ako najprchavejšia kvapalina (PEB = 49,7 ° C).
Žiadosti
Hexán sa zmieša s podobnými chemikáliami na výrobu rozpúšťadiel. Medzi mená, ktoré tieto rozpúšťadlá dostávajú, patria komerčný hexán, zmiešané hexány atď. Používajú sa ako čistiaci prostriedok v textilnom priemysle, nábytku a dutých tlači.
Hexán je prísadou lepidla používaného pri hydroizolácii strechy, v obuvi a koži. Používa sa tiež na viazanie kníh, plesní a tabliet, splachovania, výroby pneumatík a baseballových guličiek.
Hexán sa používa pri určovaní indexu minerálnych lomov a výplňovej tekutiny pre teplomery namiesto ortuti; Spravidla s červeným alebo modrým farbivom. Používa sa tiež pri extrakcii tukov a vodného oleja na analýzu jeho znečisťujúcich látok.
Hexano sa používa ako rozpúšťadlo pri extrakcii oleja zo semien rastlín, ako sú sójové bôby, repka alebo bit. Okrem toho sa používa na odmasnutie kúskov rôznych pôvodov. Používa sa pri denaturácii alkoholu, v metóde analýzy HPLC a spektrofotometrii.
Toxicita
Vdýchnutie a kontakt
Akútna toxicita hexánu je relatívne nízka, hoci je to mierny anestetický. Akútna expozícia vysokým koncentráciám hexánu môže produkovať inhaláciou, miernou depresiou centrálneho nervového systému (CNS), ktorý sa prejavuje závratmi, závratom, miernou nevoľnosťou a bolesťou hlavy.
Môže vám slúžiť: endotermická reakciaMôže tiež spôsobiť dermatitídu a podráždenie očí a krku. Vdýchnutie chronického hexánu, súvisiace s pracovnou aktivitou, môže spôsobiť poškodenie periférneho nervového systému (Sensomotorická polyneuropatia).
Počiatočné príznaky sú brnenie a kŕče nôh a ruky, po ktorých nasleduje svalová slabosť. V závažných prípadoch môže existovať atrofia kostrových svalov, spolu so stratou koordinácie a problémov s zrakom.
Hexánska toxicita súvisí s generovaním metabolitu hexánu-2,5-Diona. To reaguje s aminokyselinovým lyzínom proteínového laterálneho reťazca, čo spôsobuje stratu proteínovej funkcie.
Bezpečná dávka
Agentúra pre ochranu životného prostredia (EPA) vypočítala referenčnú koncentráciu (RFC) pre hexán 0,2 mg/m3, a referenčná dávka (RFD) 0,06 mg/kg hmotnosti/deň.
V 60. a 70. rokoch 20. storočia prítomnosť nervových zmien. Príčinou bolo, že vdýchli v atmosfére hexánu 500 - 2.500 ppm, 8-14 hodín denne.
Pracovníci predstavovali známe príznaky chronickej inhalácie Hexanu a zistili lekárov, že nervy, ktoré ovládali svaly rúk a nôh, boli poškodené.
Odkazy
- Danielle Reid. (2019). Hexán: štruktúra, vzorec a vlastnosti. Štúdium. Získané z: štúdie.com
- Národné centrum pre biotechnologické informácie. (2019). Hexán. Databáza pubchem. CID = 8058. Získané z: pubchem.Ncbi.NLM.NIH.Vláda
- Wikipedia. (2019). Hexán. Zdroj: In.Wikipedia.orgán
- Svet molekúl. (s.F.). Hexánová molekula. Získané z: Worldofmolecules.com
- Chemická kniha. (2017). Hexán. Obnovené z: Chemicalbook.com
- Austrálske spoločenstvo. (s.F.). N-Hexán: Zdroje čísel. Získané z: NPI.Vláda.Au
- EPA. (2000). Hexán. [PDF]. Získané z: EPA.Vláda
- Agentúra pre toxické látky a register chorôb. (1999). Vyhlásenie o zdraví krčmy pre N-Hexan. Zdroj: ATSDR.CDC.Vláda
- « 5 experimentov s chemickými reakciami (jednoduché a bezpečné)
- Charakteristiky Toronjil, biotop, vlastnosti, kultivácia, starostlivosť »

