Koncept, typy a príklady molekulárnej geometrie
- 2150
- 192
- JUDr. Rudolf Čapkovič
Ten Molekulárna geometria ani molekulárna štruktúra Je to priestorové rozloženie atómov okolo centrálneho atómu. Atómy predstavujú oblasti, v ktorých je vysoká elektronická hustota, a preto sa považujú za elektronické skupiny, bez ohľadu na spojenia, ktoré sa tvoria (jednoduché, dvojité alebo trojnásobné).
Molekulárna geometria prvku môže charakterizovať niektoré z jeho fyzikálnych alebo chemických vlastností (bod varu, viskozita, hustota atď.). Napríklad molekulárna štruktúra vody určuje jej rozpustnosť.
 Zdroj: Gabriel Bolívar
Zdroj: Gabriel Bolívar Tento koncept sa rodí z kombinácií a experimentálnych údajov dvoch teórií: koncepcia Link Valencia (TEV) a odpudenia elektronických párov vrstvy Valencie (RPECV). Zatiaľ čo prvý definuje prepojenia a ich uhly, druhý vytvára geometriu a následne molekulárnu štruktúru.
Aké geometrické tvary sú schopné prijať molekuly? Odpovede prispievajú dve predchádzajúce teórie. Podľa RPECV musia byť atómy a páry voľných elektrónov usporiadané do priestoru tak, aby elektrostatický odpor medzi nimi klesal na maximum.
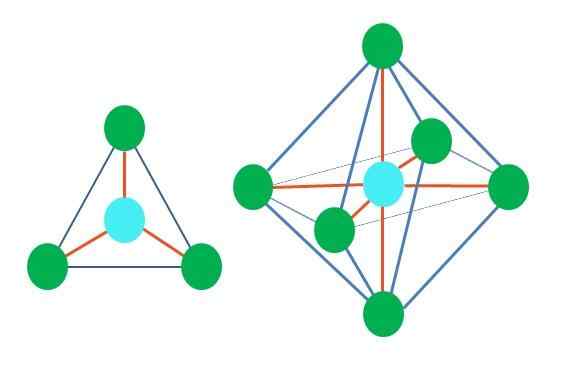
Geometrické tvary teda nie sú svojvoľné, ale hľadajú najstabilnejší dizajn. Napríklad na hornom obrázku je možné vidieť trojuholník vľavo a vpravo oktaedron. Zelené body predstavujú atómy a oranžové pruhy odkazy.
V trojuholníku sú tri zelené body orientované na separáciu 120 °. Tento uhol, ktorý sa rovná uhlu odkazu, umožňuje atóm. Preto molekula s centrálnym atómom pripojeným k trom ďalším prijme plochú trigonálnu geometriu.
RPECV však predpovedá, že pár voľných elektrónov v centrálnom atóme skreslí geometriu. V prípade trigonálnej roviny tento krútiaci moment stlačí tri zelené body, čo bude mať za následok trigonálnu geometriu pyramídy.
To isté sa môže stať aj s oktadronom obrázka. V tom sú všetky atómy oddelené čo najstabilnejším spôsobom.
[TOC]
Ako vopred vedieť molekulárna geometria atómu x?
Z tohto dôvodu je potrebné tiež považovať voľné elektróny za elektronické skupiny. Tieto, spolu s atómami, definujú, čo je známe ako Elektronická geometria, čo je neoddeliteľný spoločník molekulárnej geometrie.
Z elektronickej geometrie a po zistení párov voľných elektrónov štruktúrou Lewisu je možné stanoviť, aká bude molekulárna geometria bude. Súčet všetkých molekulárnych geometrií poskytne náčrt globálnej štruktúry.
Typy molekulárnej geometrie
Ako je možné vidieť na hlavnom obraze, molekulárna geometria závisí od toho, koľko atómov obklopuje centrálny atóm. Ak je však niekoľko elektrónov prítomných bez zdieľania, upraví geometriu, pretože zaberá veľký objem. Preto má stérický efekt.
Podľa toho môže geometria predstavovať sériu charakteristických foriem pre mnoho molekúl. A tu vznikajú rôzne typy molekulárnej geometrie alebo molekulárnej štruktúry.
Kedy je geometria rovná štruktúre? Obe to označujú iba v prípadoch, keď štruktúra nemá viac ako jeden typ geometrie; V opačnom prípade sa musia zvážiť všetky prítomné typy a poskytnúť štruktúre globálny názov (lineárne, rozvetvené, guľové, byt atď.).
Môže vám slúžiť: HydraceGeometrie sú obzvlášť užitočné na vysvetlenie štruktúry pevnej látky z jej štrukturálnych jednotiek.
Lineárny
Všetky kovalentné väzby sú smerové, takže spojenie A-B je lineárne. Ale bude molekula AB lineárna2? Ak áno, geometria je jednoducho reprezentovaná ako: B-A-B. Dva atómy B sú oddelené uhlom 180 ° a podľa TEV musí mať hybridné orbitály SP.
Uhlový
 Zdroj: Gabriel Bolívar
Zdroj: Gabriel Bolívar Lineárna geometria pre molekulu AB sa dá predpokladať v prvom inštancii2; Je však nevyhnutné nakresliť Lewisovu štruktúru pred dosiahnutím záveru. Nakreslil Lewisovu štruktúru, môžete identifikovať počet nezvyčajných párov elektrónov (:) na atóme a.
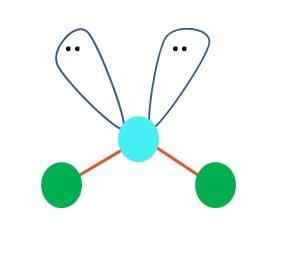
Keď je to tak, na pároch elektrónov dva atómy B dole, menia svoje uhly. Výsledkom je, že lineárna molekula B-A-B končí, že sa stáva V, boomerangom alebo uhlovou geometriou (vynikajúci obraz)
Molekula vody, H-O-H, je ideálnym príkladom pre tento typ geometrie. V atóme kyslíka sú dva páry elektrónov bez zdieľania, ktoré sú orientované v približnom uhle 109 °.
Prečo tento uhol? Pretože elektronická geometria je tetraedrálna, ktorá má štyri vrcholy: dva pre atómy H a dva pre elektróny. Na vynikajúcom obraze si všimnite, že zelené body a dva „laloky s očami“ nakreslia tetrahedron s modrým bodom v jeho strede.
Keby alebo nemali voľné elektróny, voda by tvorila lineárnu molekulu, jej polarita by sa znížila a oceány, moria, jazerá atď., Pravdepodobne by neexistovali, pretože sa navzájom poznajú.
Tetraedrálny
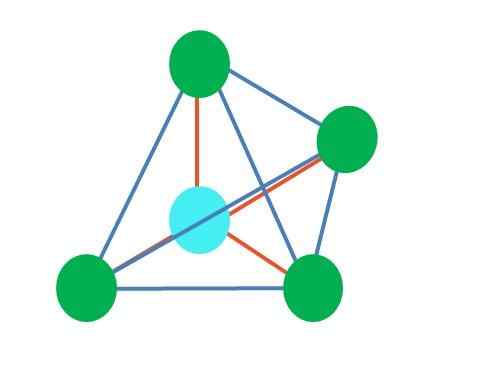 Zdroj: Gabriel Bolívar
Zdroj: Gabriel Bolívar Horný obrázok predstavuje tetraedrálnu geometriu. V prípade molekuly vody je jej elektronická geometria tetraedrálna, ale odstránením párov bez elektrónov je možné poznamenať, že sa transformuje do uhlovej geometrie. Toto je tiež pozorované aj odstránením dvoch zelených bodov; Zostávajúce dva nakreslia V modrým bodom.
Čo keby namiesto dvoch párov voľných elektrónov existovali iba jeden? Potom by tam bola trigonálna rovina (hlavný obrázok). Elimináciou elektronickej skupiny sa však nevyhýba stérickému efektu, ktorý produkuje pár voľných elektrónov. Preto skresľuje trigonálnu rovinu na trojuholníkovú základňovú pyramídu:
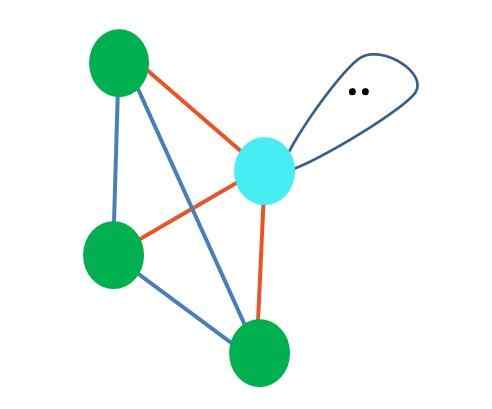 Zdroj: Gabriel Bolívar
Zdroj: Gabriel Bolívar Aj keď je molekulárna geometria trigonálna a tetraedrálna pyramída odlišná, elektronická geometria je rovnaká: tetraedrálna. Takže trigonálna pyramída sa nepočíta ako elektronická geometria?
Odpoveď znie nie, pretože je to produkt skreslenia spôsobeného „lalokom s očami“ a jeho stérickým efektom a uviedla, že geometria nezohľadňuje neskoršie skreslenie.
Z tohto dôvodu je vždy dôležité určiť prvú elektronickú geometriu pomocou Lewisových štruktúr pred definovaním molekulárnej geometrie. Molekula amoniaku, NH3, Je to príklad trigonálnej pyramídy molekulárnej geometrie, ale s tetraedrálnou elektronickou geometriou.
Trigonálny bipiramid
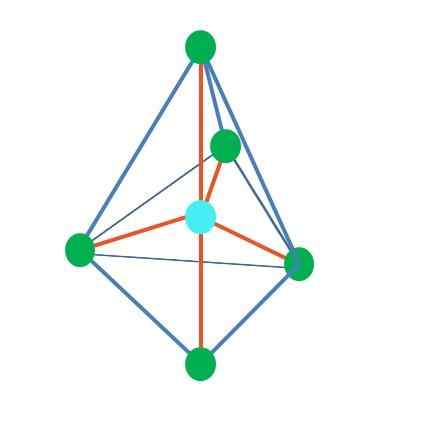 Zdroj: Gabriel Bolívar
Zdroj: Gabriel Bolívar Až doteraz, s výnimkou lineárnej geometrie, v tetraedrálnej, uhlovej a trigonálnej pyramíde, ich centrálne atómy majú hybridizáciu SP SP3, Podľa TEV. To znamená, že ak boli experimentálne určené jeho uhly spojenia, mali by byť okolo 109 °.
Môže vám slúžiť: aplikovaná chémia: objekt štúdie, vetvy, dôležitosť, príkladyZ trigonálnej difarmidálnej geometrie je okolo centrálneho atómu päť elektronických skupín. Na hornom obrázku môžete vidieť s piatimi zelenými bodmi; tri v trojuholníkovej základni a dva v axiálnych polohách, ktoré sú hornými a dolnými vrcholmi pyramídy.
Aká hybridizácia potom má modrý bod? Potrebuje päť hybridných orbitálov na vytvorenie jednoduchých (oranžových) dlhopisov. To to dosahuje cez päť orbitálov SP3D (produkt zmesi orbitálu S, Tri P a One D).
Pri zvažovaní piatich elektronických skupín je geometria už vystavená, ale s párami elektrónov bez zdieľania, opäť trpí skresleniami, ktoré generujú ďalšie geometrie. Podobne vyvstáva nasledujúca otázka: Tieto páry môžu zaberať akúkoľvek pozíciu pyramídy? To sú: axiálne alebo rovník.
Axiálne a rovné pozície
Zelené body, ktoré tvoria trojuholníkovú základňu, sú v rovníkových polohách, zatiaľ čo dva na horných a dolných koncoch, v axiálnych polohách. Kde sa prednostne bude pár elektrónov umiestniť bez zdieľania? V tejto polohe, ktorá klesá na maximálny elektrostatický odpor a stérický účinok.
V axiálnej polohe by pár elektrónov spôsobil „tlak“ kolmá (90 °) na trojuholníkovej báze, zatiaľ čo keby bol v rovníkovej polohe, zostávajúce elektronické skupiny základne by boli oddelené 120 ° a stlačte dva konce pri 90 ° (namiesto toho. tri, ako pri základni).
Preto sa centrálny atóm bude snažiť viesť svojich kolegov bez elektrónov v rovníkových polohách, aby sa vytvorili stabilnejšie molekulárne geometrie.
Oscilujúce a forma t
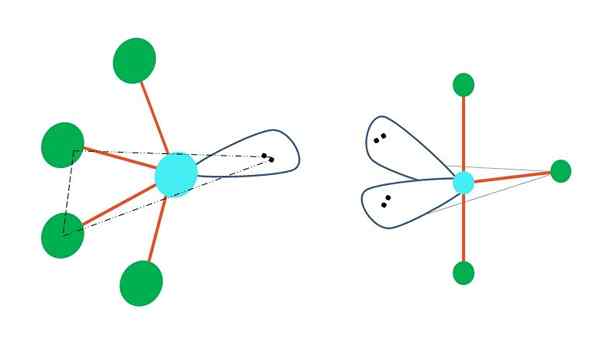 Zdroj: Gabriel Bolívar
Zdroj: Gabriel Bolívar Ak by sa jeden alebo viac jeho atómov bez elektrónov vymenil v trigonálnej bipirramidovej geometrii, mali by tiež rôzne molekulárne geometrie.
Vľavo od horného obrázka sa geometria mení v oscilačnom tvare. V ňom moment bez elektrónu tlačí zvyšky štyroch atómov rovnakým smerom a ohýba ich odkazy naľavo. Všimnite si, že tento krútiaci moment a dva atómy ležia v rovnakej trojuholníkovej rovine pôvodného bipiramidu.
A napravo od obrázka, geometria v tvare t. Táto molekulárna geometria je výsledkom nahradenia dvoch atómov dvoma pármi elektrónov, čo vedie k tomu, že zostávajúce tri atómy sa zarovnajú v rovnakej rovine, ktorá presne nakreslí písmeno t.
Takže pre molekulu typu ab5, To prijíma trigonálnu bipyramidovú geometriu. Avšak AB4, S rovnakou elektronickou geometriou bude prijať oscilujúcu geometriu; a ab3, Geometria t -tvare. Vo všetkých z nich bude mať (všeobecne) hybridizáciu SP3d.
Na stanovenie molekulárnej geometrie je potrebné nakresliť Lewisovu štruktúru, a teda jej elektronickú geometriu. Ak je to trigonálny bipiramid, páry bez elektrónov sa potom vyradia, ale nie ich stérické účinky na zvyšok atómov. Môže sa teda dokonale rozlišovať medzi tromi možnými molekulárnymi geometriami.
Oktadrálny
Napravo od hlavného obrazu je zastúpená oktaedrálna molekulárna geometria. Tento typ geometrie zodpovedá zlúčeninám AB6. AB4 Tvoria štvorcovú základňu, zatiaľ čo zostávajúce dve B sa polohujú v axiálnych pozíciách. Týmto sa vytvára niekoľko rovnostranných trojuholníkov, ktoré sú tvárami oktaedronu.
Môže vám slúžiť: aktivačná energiaTu opäť môže existovať (ako vo všetkých elektronických geometriách) páry voľných elektrónov, a preto z tejto skutočnosti vyplývajú z iných molekulárnych geometrií. Napríklad AB5 S oktronistickou elektronickou geometriou pozostáva z pyramídy s štvorcovým základom a AB4 štvorcovej roviny:
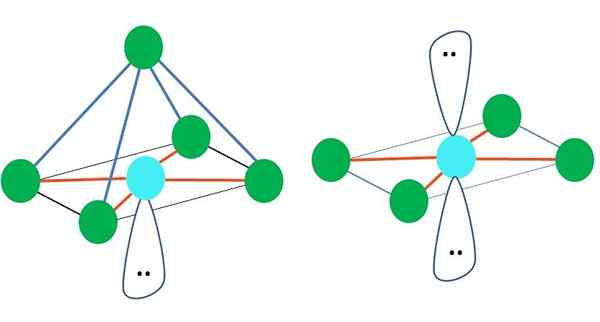 Zdroj: Gabriel Bolívar
Zdroj: Gabriel Bolívar V prípade oktronistickej elektronickej geometrie sú tieto dve molekulárne geometrie najstabilnejšie z hľadiska elektrostatického odporu. V štvorcovej plochej geometrii sú dva páry elektrónov oddelené 180 °.
Čo je hybridizácia pre atóm v týchto geometroch (alebo štruktúry, ak je jediná)? TEV opäť ustanovuje, že je to SP3d2, Šesť hybridných orbitálov, ktoré vám umožňujú viesť elektronické skupiny vo vrcholoch oktaedronu.
Ostatné molekulárne geometrie
Modifikácia základov pyramíd doteraz je možné získať niektoré zložitejšie molekulárne geometrie. Napríklad pentagonálny bipiramid je založený na pentagóne a zlúčeninách, ktoré majú všeobecný vzorec AB7.
Rovnako ako ostatné molekulárne geometrie, nahradenie atómov B za páry bez elektrónov skreslí geometriu na iné formy.
Tiež zlúčeniny AB8 Môžu si osvojiť geometrie, ako je napríklad štvorcový antiprizmus. Niektoré geometrie môžu byť veľmi komplikované, najmä pre AB vzorce7 Odteraz12).
Príklady molekulárnej geometrie
Pre každú z hlavných molekulárnych geometrií bude uvedená séria zlúčenín. Ako cvičenie by sa mohlo vyvodiť Lewisove štruktúry pre všetky príklady a certifikovať, či sa vzhľadom na elektronickú geometriu získajú molekulárne geometrie, ako sú uvedené nižšie.
Lineárna geometria
-Etylén, h2C≡ch2
-Berylium chlorid, Becl2 (Cl-be-cl)
-Oxid uhličitý, CO2 (O = c = o)
-Dusík, n2 (N≡n)
-Ortuťová dibromure, HGBR2 (BR-HG-BR)
-Triyoduro Anion, i3- (I-i-i)
-Kyselina Madehydrová, HCN (H-N≡C)
Jeho uhly musia byť 180 °, a preto majú hybridizáciu SP.
Uhlová geometria
-Vodná voda
-Oxid siričitý, tak2
-Oxid dusíka, nie2
-Ozón, alebo3
-Amiduro Anion, NH2-
Trigonálny byt
-Bróm trifluorid, bf3
-Hliník trichlorid, Alcl3
-Anión dusičnanov, nie3-
-Uhličitan, CO32-
Tetraedrálny
-Plyn metano, ch4
-Uhlíkový tetrachlorid, CCL4
-Amónny, NH4+
-Sulfátový anión, tak42-
Trigonálna pyramída
-Amoniak, NH3
-Hydronio katión, h3Ani+
Trigonálny bipiramid
-Fosfor pentafluoruro, pf5
-Antimónový pentachlorid, SBF5
Oscilujúci
Sulfur tetrafluorid, sf4
Forma t
-Jódový trichlorid, ICL3
-Chlór trifluorid, CLF3 (Obe zlúčeniny sú známe ako interhalogény)
Oktadrálny
-Hexafluoruro zo Síry, SF6
-Selén hexafluoruro, SEF6
-Hexaflorofosfát, PF6-
Na vyvrcholenie je molekulárna geometria tá, ktorá vysvetľuje pozorovania chemických alebo fyzikálnych vlastností veci. Je však orientovaný podľa elektronickej geometrie, takže táto musí byť vždy určená pred prvým.
Odkazy
- Whitten, Davis, Peck & Stanley. Chémia. (8. vydanie.). Cengage Learning, str. 194-198.
- Triasť a Atkins. (2008). Anorganická chémia. (Štvrté vydanie., p. 23, 24, 80, 169). MC Graw Hill.
- Značka e. Klenot. (2011). Molekulárna geometria a teória VSEPR. Získané z: NYU.Edu
- Virtuálna chembook, Charles a. Hneda. (2003). Úvod do molekulárnej geometrie. Získané z: chémie.elmhursst.Edu
- Chémia librettexts. (8. september 2016). Geometria molekúl. Získané z: Chem.Librettexts.orgán

