Ideálny plynový model, správanie, príklady
- 686
- 37
- Tomáš Mydlo
A Ideálny plyn ani Perfektný plyn Je to taká, v ktorej sa sila príťažlivosti alebo molekulárneho odporu považuje.
V takom plyne sú častice zvyčajne dosť ďaleko od seba, aj keď občas sa navzájom zrážajú a so stenami nádoby.
 V ideálnom plyne sú častice mimo seba od seba
V ideálnom plyne sú častice mimo seba od seba Na druhej strane, v ideálnom plyne, veľkosť alebo hmotnosť častíc nezáleží, pretože objem, ktorý obsadil, má byť veľmi malý v porovnaní s objemom samotného plynu.
Toto je, samozrejme, iba prístup, pretože v skutočnosti vždy existuje určitý stupeň interakcie medzi atómami a molekulami. Tiež vieme, že častice zaberajú priestor a majú hmotnosť.
Tieto predpoklady však v mnohých prípadoch fungujú celkom dobre, napríklad plyny s nízkou molekulovou hmotnosťou, v dobrom rozsahu tlakov a teplôt.
Plyny s vysokou molekulovou hmotnosťou, najmä pri vysokých tlakoch alebo nízkych teplotách, sa však vôbec nebudú správať ako ideálne plyny a potrebujú ďalšie modely vytvorené s cieľom ich opisovať s väčšou presnosťou.
[TOC]
Prvé experimenty
Zákony, ktoré riadia plyny, sú empirické, to znamená, že vznikli z experimentovania. Najvýznamnejšie experimenty sa uskutočnili v sedemnástom, osemnástom a začiatku devätnásteho storočia.
Prvými sú tí z Roberta Boyla (1627-1691) a Edme Mariotte (1620-1684), ktorí nezávisle upravili tlak v plyne a zaregistrovali ich zmenu zväzok, Zistenie, že boli nepriamo úmerné: pri väčšom tlaku, menší objem.
 Robert Boyle
Robert Boyle Pokiaľ ide o jeho časť, Jacques Charles (1746-1823) stanovil tento objem a teplota Absolútne boli priamo proporcionálne, pokiaľ tlak zostal konštantný.
Môže vám slúžiť: stacionárne vlny: vzorce, charakteristiky, typy, príkladyAmadeo Avogadro (1776-1856) zistil, že dva rovnaké objemy rôznych plynov obsahovali rovnaké množstvo častíc, pokiaľ tlak a teplota boli rovnaké. A nakoniec Joseph de Gay Lussac (1778-1850), uviedol, že udržiavaním objemu pevného objemu je tlak v plyne priamo úmerný teplote.
Zákony ideálnych plynov
Tieto objavy sú vyjadrené prostredníctvom jednoduchých vzorcov, volajú p tlak, Vložka objem, n na počet častíc a Tón Ideálna teplota plynu:
Boyle-Maleotte zákon
Za predpokladu, že je teplota pevná, nastane nasledujúce:
P zajtra
Charles zákon
Keď je plyn pod konštantným tlakom:
V / t = konštanta
Gay Lussac zákon
Udržiavanie plynu pri pevnom objeme je pravda, že:
P / T = konštanta
Avogadro zákon
Rovnaké objemy plynu, za rovnakých podmienok tlaku a teploty, majú rovnaký počet častíc. Preto môžeme napísať:
V ∝ n
Kde n je počet častíc a ∝ je symbolom proporcionality.
Model ideálneho plynu
Model ideálneho plynu opisuje plyn tak, že:
-Keď to častice interagujú na veľmi krátku dobu, prostredníctvom elastických zrážok, v ktorých sa zachováva impulz a kinetická energia.
-Jeho zložkové častice sú presné, inými slovami, jeho priemer je oveľa nižší ako priemerná vzdialenosť, ktorú cestujú medzi jednou a druhou kolíziou.
-Intermolekulárne sily neexistujú.
-Kinetická energia je úmerná teplote.
Monoatomické plyny - ktorých atómy nie sú navzájom spojené - a nízka molekulová hmotnosť, v štandardných podmienkach tlaku a teploty (atmosférický tlak a teplota 0 ° C), majú také správanie, že ideálny model plynu je veľmi dobrý opis pre nimi.
Môže vám slúžiť: Vy Canis Majoris: Objav, charakteristiky, štruktúra, školenie a vývojIdeálna rovnica stavu plynu
Zákony vyššie uvedených plynov sú kombinované tak, aby tvorili všeobecnú rovnicu, ktorá riadi ideálne správanie plynu:
V ∝ n
V ∝ t
Preto:
V ∝ N⋅t
Okrem toho Boyleov zákon:
V = konštanta / p
Potom to môžeme potvrdiť:
V = (konštanta x n⋅t) / p
Konštanta sa nazýva plynná konštanta A je označený písmenom R. S touto voľbou sa ideálny plynový rovnica týka štyroch premenných, ktoré opisujú stav plynu, konkrétne N, R, P a T, odchádza:
P zajtra
Táto relatívne jednoduchá rovnica je v súlade so zákonmi ideálnych plynov. Napríklad, ak je teplota konštantná, rovnica sa zníži na zákon Boyle-Maleotte.
Plynná konštanta
Ako sme už povedali, v štandardných podmienkach teploty a tlaku, to znamená pri 0 ° C (273.15 k) a 1 tlaková atmosféra je správanie mnohých plynov blízko ideálneho plynu. Za týchto podmienok je objem 1 mol plynu 22.414 L.
V tom prípade:
R = (p⋅v) / (N⋅t) = (1 atm x 22.414 l) / (1 mol x 273.15 k) = 0.0821 ATM ⋅ l /mol ⋅ k
Plynovacia konštanta je možné vyjadriť aj v iných jednotkách, napríklad v medzinárodnom systéme, ak stojí za to:
R = 8 314 j⋅ mol-1⋅ K-1
Ak sa problém vyrieši prostredníctvom zákona o ideálnych plynoch, je vhodné venovať pozornosť jednotkám, v ktorých je konštanta vyjadrená, pretože ako vidíme, existuje veľa možností.
Správanie ideálneho plynu
Ako sme už povedali, akýkoľvek plyn v štandardných tlakových a teplotných podmienkach s nízkou molekulovou hmotnosťou sa správa veľmi blízko k ideálnemu plynu. Preto je rovnica p zajtra = n⋅r⋅t použiteľná na nájdenie vzťahu medzi štyrmi premennými, ktoré ho opisujú: n, p, v a t.
Môže vám slúžiť: Heisenberg Atomic ModelTýmto spôsobom si dokážeme predstaviť ideálnu časť plynu zamknutú v nádobe a tvorená malými časticami, ktoré sa občas stretávajú medzi sebou a so stenami nádoby, vždy elasticky elasticky.
To je to, čo vidíme v nasledujúcej animácii héliovej časti, ušľachtilé a monoatomické plyn:
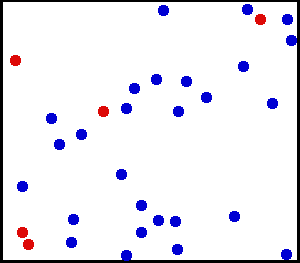 Hélium je ušľachtilý plyn, v animácii je časť atómov hélia zobrazená v nádobe. Červené slúžia na lepšie rozlíšenie pohybu. Zdroj: Wikimedia Commons.
Hélium je ušľachtilý plyn, v animácii je časť atómov hélia zobrazená v nádobe. Červené slúžia na lepšie rozlíšenie pohybu. Zdroj: Wikimedia Commons. Príklady ideálnych plynov
Ideálny plyn je hypotetický plyn, to znamená, že ide o idealizáciu, avšak v praxi sa mnohí plyny správajú veľmi blízko, čo umožňuje pre model P zajtra = Nood.
Šľachetné plyny
Príkladom plynov, ktoré sa za štandardných podmienok správajú ako ideály, sú ušľachtilé plyny, ako aj ľahké plyny: vodík, kyslík a dusík.
Aerostatický balón
 Model ideálneho plynu vysvetľuje, ako horúci vzduchový balón. Zdroj: Wikimedia Commons.
Model ideálneho plynu vysvetľuje, ako horúci vzduchový balón. Zdroj: Wikimedia Commons. Na aerostatický balón na obrázku 1 sa dá uplatniť podľa Charlesovho zákona: plyn je zahrievaný, a preto vzduch, ktorý vyplní zemeguľu, sa rozširuje a v dôsledku toho stúpa.
Héliové balóny
Hélium je spolu s vodíkom najbežnejším prvkom vo vesmíre, a napriek tomu je na Zemi vzácny. Ako šľachetný plyn je inertný, na rozdiel od vodíka, takže héliové balóny sa široko používajú ako dekoratívne prvky.
Odkazy
- Atkins, str. 1999. Fyzikálna chémia. Vydanie omega.
- Chang, R. 2013. Chémia. 11 VA. Vydanie. MC Graw Hill Education.
- Cengel a. 2012. Termodynamika. 7. vydanie. McGraw Hill.
- Cimbala, C. 2006. Mechanika tekutín, základov a aplikácií. MC. Graw Hill.
- Giambattista, a. 2010. Fyzika. Druhý. Edimatizovať. McGraw Hill.
- « Charakteristiky prírodného prostredia, prvky, dôležitosť, príklady
- Príklady a charakteristiky odvolacieho funkcie »

