Van der Waals sily
- 4730
- 850
- Alfréd Blaho
Vysvetlíme, čo sú van der Waals sily, ich charakteristiky, typy a uvádzajte príklady v každom
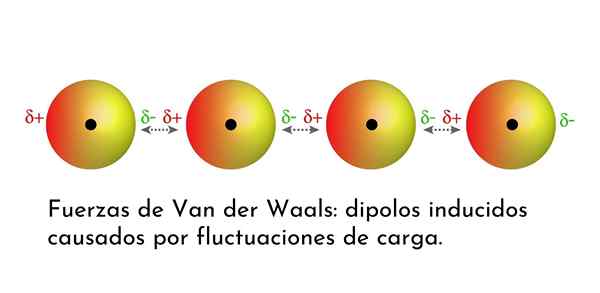
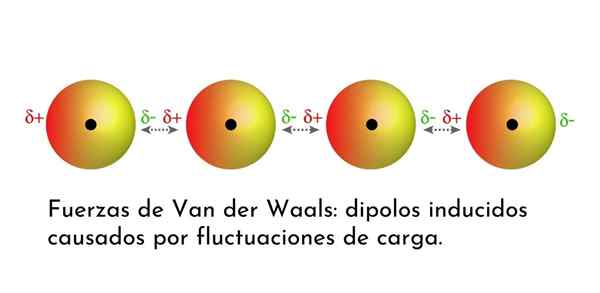 Ilustrácia, ktorá ukazuje jeden z typov síl Van der Waals, londýnske disperzné sily, medzi niekoľkými atómami s okamžitým dipólom
Ilustrácia, ktorá ukazuje jeden z typov síl Van der Waals, londýnske disperzné sily, medzi niekoľkými atómami s okamžitým dipólom Aké sú sily Van der Waals?
Ten Van der Waals sily Sú setou krátkych príťažlivých síl medzi všetkými atómami a molekulami. Dostávajú svoje meno na počesť holandského vedca Johannes Diderik van der Waals.
Tieto sily sú relatívne slabé, ale objavujú sa na celom kontaktnom povrchu medzi dvoma atómami, medzi dvoma molekulami alebo medzi dvoma povrchmi, takže ak je uvedený kontaktný povrch veľký, sily Van der Waals môžu byť značné.
Pochopenie síl Van der Waals umožňuje kvalitatívne predpovedanie mnohých fyzikálnych vlastností chemických látok, ako sú ich topenie a varné body a rozpustnosť v rôznych typoch rozpúšťadiel. Toto sú sily, ktoré umožňujú vysvetliť, ako je možné, že monoatomický plyn, ako je hélium, ktorý netvorí žiadny typ chemickej väzby, môže kondenzovať a presunúť sa do tekutého stavu.
Tieto sily tiež vysvetľujú, prečo je látka, ako je voda, ktorá je tvorená molekulami, ktorých molárna hmota je iba 18 g/mol, je tekutá, zatiaľ čo chlór, ktorý váži takmer 4 -krát viac, je plyn pri teplote miestnosti.
Charakteristiky sily van der Waals
Okrem toho, že predstavujú typ príťažlivej sily medzi atómami a molekulami, sily Van der Waals nezdieľajú veľa charakteristík s chemickými väzbami. Ďalej sú uvedené najvýznamnejšie charakteristiky tohto typu síl:
- Sú to sily závislé od vzdialenosti. V najjednoduchšom prípade sa znižujú s štvorcom vzdialenosti. Okrem toho silne závisia od molekulárnej geometrie.
- V porovnaní s príťažlivými silami, ktoré sa vyskytujú v iónových, kovalentných a kovových väzbách, sú sily Van der Waals relatívne slabé.
- S výnimkou interakcií dipólu-dipolo sú to nezávislé teplotné interakcie.
- Sú to krátkodobé sily, čo znamená, že rýchlo klesajú, keď sa atómy a molekuly pohybujú preč.
- Sú to všeobecné sily, ktoré sa vyskytujú medzi akýmkoľvek atómom a akoukoľvek molekulou.
- Na rozdiel od kovalentných väzieb nemajú pokyny. To znamená, že bez ohľadu na orientáciu, s ktorou sa priblížia dve molekuly, ak sa dostatočne priblížia, sa vždy objavia sily Van der Waals.
- Keď sa dve molekuly alebo atómy príliš priblížia, sila sa stáva odpudivou, čo bráni molekulám v tom, aby sa navzájom zrútili.
- Sú aditívne, čo znamená, že napriek tomu, že existencia mnohých súčasných interakcií môže byť značne slabá.
Typy van der Waalsových síl
Okrem odpudivej zložky, ktorá zaisťuje, že atómy a molekuly sa nezriedu, existujú tri typy van der Waalsových síl, ktoré môžu alebo nemusia pôsobiť súčasne medzi dvoma molekulami alebo atómami. Tieto sú uvedené nižšie:
1. Dipbolo-dipolo interakcie alebo sily Keesom
Sila Keesoma je jedným z daňovníkov pre silu Van der Waals. Toto sú elektrostatické interakčné sily, ktoré sa objavujú medzi trvalými dipólami polárnych molekúl, ako je voda, acetón a ďalšie.
Keesomove sily sú podobné elektrostatickým silám medzi iónmi, ale od nich sa líšia v tom, že sú omnoho slabšie a rozpadajú sa šiestou silou vzdialenosti (to znamená s R6). Dôvod, prečo sú slabšie, je to, že k príťažlivosti dochádza medzi čiastočným zaťažením dipólu, namiesto celých elektrických nábojov, ako je v prípade iónov.
Tieto interakcie sa podávajú iba medzi molekulami a nie medzi atómami, pretože atómy nemajú trvalé dipólové momenty. Okrem toho je Keesomova sila nepriamo úmerná teplote, čo znamená, že keď sa zvyšuje, Keesomova sila klesá.
Príklady molekúl, ktoré majú interakcie dipólu-dipolo
Všetky polárne molekuly majú medzi nimi interakcie dipólu-dipól. Napríklad:
- Dve molekuly acetónu.
- Dve molekuly chloroform.
- Molekula cyklohexanónu s molekulou acetónu.
2. Indukované dippolo-dipolo interakcie alebo debye sily
Keď sa polárna molekula blíži k atómu alebo apolárnej molekule, dipól prvého priťahuje alebo opakuje elektróny na povrchu druhého. To indukuje dipól v apolárnej molekule, ktorá sa nazýva indukovaný dipól. Vytvorilo sa nový dipól a potom interaguje s pôvodným dipólom a vytvára malú silu príťažlivosti.
Môže vám slúžiť: spaľovacie teploTieto interakcie medzi trvalým a indukovaným dipólom sú zvyčajne známe ako Debye sily a závisia nielen od vzdialenosti medzi dvoma molekulami alebo medzi polárnou molekulou a jednotlivým atómom, ale tiež závisia od polarizovateľnosti apolárnej molekuly a veľkosti a veľkosti dipólového momentu polárnej molekuly.
Príklady molekúl, ktoré vyvolali interakcie dipólu-dipól
Tento druh interakcií sa podáva iba medzi rôznymi molekulami, pretože je potrebné byť polárny a druhý nie. Niektoré príklady sú:
- Atóm šľachetného plynu, ako je argón a polárna zlúčenina, ako je chlorid vodíka. V tomto prípade pozitívne čiastočné zaťaženie v HCl vodíku priťahuje elektróny argónu vo Valencii, čím vytvára malý dipol vyvolaný v druhom. Ak sa argón priblíži k atómu chlóru, negatívne čiastočné zaťaženie odrazí valenčné elektróny a vytvorí sa aj indukovaný dipól.
- Molekulárny bróm (BR2) Je značne rozpustný vo vode, napriek tomu, že ide o apolárnu zlúčeninu a vodu silne polárneho rozpúšťadla. Vysvetlenie je čiastočne spôsobené vysokou polarizovateľnosťou brómu, ktorá vám umožňuje vytvárať značne silné interakcie.
3. Indukované interakcie vyvolané dipolo-dipolo alebo londýnske disperzné sily
Zo síl Van der Waals sú najslabšie londýnske disperzné sily. Tieto interakcie sú uvedené medzi všetkými atómami a molekulami kvôli vzhľadu okamžitých dipólov v ktorejkoľvek časti ich štruktúry.
Okamžitý dipól je malý dipól, ktorý je tvorený asymetrickým rozdelením valenčných elektrónov v danom čase.
Môže vám slúžiť: nenasýtené uhľovodíkyAko sa generujú okamžité dipóly?
Pretože sa elektróny otáčajú okolo jadra, môže sa stať, že naraz je na jednej strane viac elektrónov ako z druhej, čo vedie k dipólu. Tento malý dipól rýchlo zmizne, keď sa elektróny naďalej pohybujú okolo jadra, a preto sa nazývajú snímky.
Okamžité dipóly môžu vzniknúť kdekoľvek v štruktúre molekuly a kedykoľvek ich môže byť veľa z nich. Londýnske disperzné sily pozostávajú z interakcie medzi týmito okamžitými časmi v jednej molekule a silami iného.
Príklady zlúčenín, ktoré majú londýnske disperzné sily
Ako už bolo uvedené, tieto typy interakcií sa vyskytujú medzi všetkými atómami a molekulami. Je to však vo veľkých apolárnych molekulách, kde je možné lepšie pozorovať jeho účinok, pretože v týchto prípadoch sa vyskytuje jediný typ intermolekulárnej interakcie.
Typickým príkladom, v ktorom sú tieto sily veľmi intenzívne, je v prípade alifatických uhľovodíkov s dlhým reťazcom, najmä v polyméroch, ako je polyetylén.

