Štruktúra fosforečnanu sodného, vlastnosti, syntéza, používa

- 5111
- 737
- Denis Škriniar
On Fosfát sodný Je to anorganická soľ, ktorej chemický vzorec je NA3Po4. Dostáva tiež trisodické názvy fosfátov (TSP pre svoju skratku v angličtine: Fosforečnan trisodium) alebo kmeňový fosforečnan sodný, pretože mu úplne chýba schopnosť darovať vodíkové ióny h+.
Keď sa o ňu zmienku o sodný fosforečnany hovorí, hovorí sa o celom kompendiu solí, hydratovaných alebo nie, pochádza z elektrostatických interakcií medzi Nala+ a po43-. Niektoré z týchto solí dokonca pozostávajú z pyrofosforečnanov sodného alebo anorganických polymérov, ktoré majú PO43- ako monomér.
 Hodinové sklo s kryštálmi sodný sodný. Zdroj: Ondřej Mangl [verejná doména]
Hodinové sklo s kryštálmi sodný sodný. Zdroj: Ondřej Mangl [verejná doména] Preto, pokiaľ sa neurobí špecifikácia, bude sa vždy odkazovať na NA3Po4, A nie na NAH2PO4, na2HPO4, Nat4P2Ani7 Nie žiadna iná soľ.
Horný obrázok ukazuje vzhľad fosforečnanu sodného, ktorý vyzerá bielymi kryštálmi podobnými kryštálom ako bežnej soli alebo stola, alebo kúpený ako biely prášok vyzerajúci amorfný. Potom3Po4 je schopný tvoriť niekoľko hydrátov, čo je NA3Po4· 12h2Alebo ten, ktorý je najviac na trhu.
Nájde použitie hlavne v potravinárskom priemysle, v detergentoch, športových doplnkoch a slúži ako hyperosmotický preháňadlo.
[TOC]
Chemická štruktúra
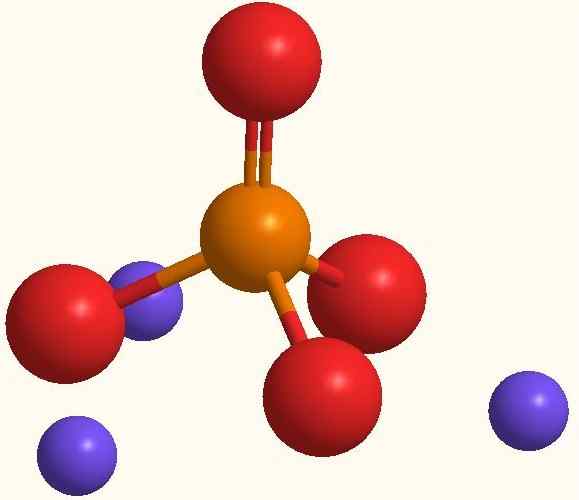 Hlavné ióny fosforečnanu sodného. Zdroj: Smolamj cez Wikipedia.
Hlavné ióny fosforečnanu sodného. Zdroj: Smolamj cez Wikipedia. Rovnaký vzorec NA3Po4 naznačuje, že pre každý anión PO43- Existujú tri katióny+. Tieto ióny sa dajú pozorovať na vynikajúcom obraze. Všimnite si, že PO43- Má tetraedrálnu geometriu, pričom jej atómy kyslíka majú rezonančné negatívne zaťaženie, ktoré priťahuje NA+ životné prostredie.
Tiež, vzorec NA3Po4 Poukazuje na to, že ide o bezvodú soľ, takže v ich kryštáloch nie sú zahrnuté žiadne molekuly vody. Elektrostatické atrakcie medzi na+ a po43- Nakoniec definujú trigonálny biely kryštál. Jeho iónové spojenie je také3Po4 Má fúzny bod 1583 ° C, podstatne vyšší ako v niekoľkých solí.
Môže vám slúžiť: Cannizzaro Reakcia: Charakteristiky, mechanizmy, príkladyObidve na+ Ako po43- Sú to ióny, ktoré sa dajú hydratovať vo vysokom stupni, bez toho, aby negatívne ovplyvnili stabilitu kryštálov.
Z tohto dôvodu môžu hydráty tiež kryštalizovať; Jeho topiace sa body sú však nižšie ako body bezvodej soli, pretože intermolekulárne vodíkové mosty vody oddeľujú ióny a oslabujú ich interakcie. V NA3Po4· 12h2Alebo napríklad jeho bod topenia je 73,4 ° C, oveľa menej ako na Na3Po4.
Vlastnosti
Fyzický vzhľad
Môže sa vyskytnúť ako definované biele kryštály alebo ako prach alebo granule rovnakej farby. Všetky fyzikálne veľkosti vyjadrené nižšie narážajú iba na naivnú soľ3Po4.
Bod topenia
1583 ° C
Bod varu
100 ° C
Rozpustnosť
14,5 g/100 ml pri 25 ° C, takže sa považuje za celkom rozpustný fosfát vody. Je však nerozpustný v organických rozpúšťadlách, ako je etanol a disulfid uhlíka.
Hustota
2 536 g/cm3 pri 17,5 ° C.
Stabilita
Je to hygroskopická tuhá látka. Preto musí byť uložený takým spôsobom, aby nebol vystavený vlhkosti.
pH
Je to silne zásaditá soľ. Napríklad, vodný roztok z 0,1% už má pH 11,5. Táto vlastnosť slúži na použitie ako prísada v detergentoch.
Syntéza
Ako sa vyrába alebo syntetizuje fosfát sodný? Na tento účel je založený na kyseline fosforečnej, h3Po4, alebo zo soľného soľného sodíka, NAH2Po4.
V drvivej väčšine syntézy sa uprednostňuje H3Po4. Tak reaguje H3Po4 So základňou, ktorá neutralizuje svoje tri skupiny OH, berúc do úvahy, že táto kyselina je možné napísať aj ako PO (OH)3.
Môže vám slúžiť: Rovnováha predmetu: Čo je, všeobecná rovnica, typyPodľa preferencie je hydroxid sodný, NaOH (v Nemecku), ale je tiež životaschopný (a lacnejší) na používanie uhličitanu sodného alebo popol SOSA, NA2Co3 (v Spojených štátoch). Rovnice oboch neutralizačných reakcií sú:
Nat2Co3 + H3Po4 → NA2HPO4 + Co2 + H2Ani
Nat2HPO4 + NaOH → NA3Po4 + H2Ani
Všimnite si, že pri používaní NA2Co3 NA sa nezískava3Po4 ale na2HPO4, ktoré budú potrebovať následnú neutralizáciu. Ako vodná reakcia znamená, kryštalizuje NA3Po4· 12h2Alebo, preto sa musí vypočítať tak, aby eliminoval jej obsah vody a spôsobil bezvodú soľ.
Potom3Po4· 12h2O sa vyznačuje „zlúčením“ ich kryštálov v ťažkej kompaktnej hmote. Čím menšia je veľkosť ich kryštálov, tým rýchlejšie bude jej kalcinácia.
Žiadosti
Jedlo
 Fosforečnan sodný sa používa ako šumivé činidlo na rozšírenie škoricových úloh alebo koláčov. Zdroj: Pixabay.
Fosforečnan sodný sa používa ako šumivé činidlo na rozšírenie škoricových úloh alebo koláčov. Zdroj: Pixabay. V používa fosforečnan sodný nevyhnutný na zmiešanie NA3Po4 alebo na3Po4· 12h2Alebo, pretože druhý je hydrát, ktorý sa najviac uvádza na trh. Napríklad jeden z nich poskytuje neškodné (teoreticky) ióny pre jedlo, ku ktorému sú pridané, obohacujú ich fosfáty a zároveň zvyšujú svoju slanosť.
V salári mäsa, NA3Po4· 12h2Alebo je zahrnuté, aby boli počas skladovania dlhšie čerstvé. Pridáva sa tiež ako emulgačné činidlo, takže zmes olej-voda nie je „rezaná“, ale zostáva zjednotená; A ako regulátor pH, pretože pomáha znižovať kyslosť potravín (vrátane obilnín).
Môže vám slúžiť: kremičitan vápenatý: vlastnosti, štruktúra, získanie, používanieOkrem toho sa používa na zahusťovanie niektorých omáčok z paradajok a na pečenie koláča alebo chleba (vynikajúci obrázok). Druhý je preto, že NA3Po4· 12h2Alebo má tendenciu uvoľňovať vodnú paru, čo zvyšuje veľkosť pórov hmotnosti múky a objem ich.
Detergenty
Fosforečnan sodný je dostatočne základný na to, aby zanedbával niektoré tuky alebo oleje, s ktorými máte kontakt. Jeho alkalita sa potom používa na zlepšenie pôsobenia detergentov, pokiaľ povrch na bieda nie je kov, pretože ju môžu zhoršiť.
Produkcia detergentov obohatených fosfátami sa však znížila, pretože produkujú eutrofizáciu jazier a riek a s ním proliferácia rias, ktoré pokrývajú ich povrchy.
Používa sa tiež na vypracovanie dezinfekčného prostriedku: na3Po4· 1/4Naocl · 11h2Alebo, ktorý sa pripravuje s použitím chlórnanu sodného, naocl, namiesto NaOH alebo NA2Co3 Na neutralizáciu h3Po4.
Liečivý
Potom3Po4 Indukuje defekáciu pôsobením ako hyperosmotický preháňadlo, ktoré je potrebné na vyčistenie hrubého čreva skôr, ako pacient podstúpi kolonoskopiu. Na druhej strane sa použil (pridaný) v energetických doplnkoch.
Odkazy
- Triasť a Atkins. (2008). Anorganická chémia. (Štvrté vydanie). MC Graw Hill.
- Národné centrum pre biotechnologické informácie. (2019). Fosforečnan trisodium. Databáza pubchem. CID = 24243. Získané z: pubchem.Ncbi.NLM.NIH.Vláda
- Wikipedia. (2019). Fosforečnan trisodium. Zdroj: In.Wikipedia.orgán
- Curran m.P. & Plossker G.L. (2004). Roztok perorálneho fosforečnanu sodného: prehľad jeho použitia na čistiaci prostriedok na hrubosť. Doi: 10.2165/00003495-200464150-00009
- Corey Whelan. (22. decembra 2017). Fosfát sodný. Získané z: Healthline.com
- Jacobs, Joel B. Taborosi, Steve. (2019). Proces výroby fosforečnanu trisodia. Zdroj: Freepatentssonline.com
- Maryann Marks. (2018). Prečo je do nášho jedla pridaný fosforečnan Trisodium (TSP)? Získané z: theingredientGuru.com

