Fluorid draslíka (KF)
- 2089
- 216
- Valentín Dula
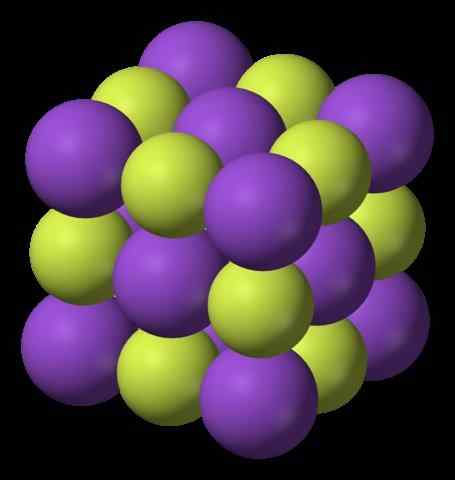
 Štruktúra fluoridu draslíka. Zdroj: Benjah-Bmm27, Wikimedia Commons
Štruktúra fluoridu draslíka. Zdroj: Benjah-Bmm27, Wikimedia Commons Čo je fluorid draselný?On Fluorid draslíka Je to anorganický halogenid, ktorý pozostáva zo soli vytvorenej medzi kovom a halogénom. Jeho chemický vzorec je KF, čo znamená, že pre každú katión K+ Je tu- náprotivok. Interakcie sú elektrostatické a v dôsledku toho neexistujú žiadne kovalentné spojenia K-F.
Táto soľ sa vyznačuje svojou extrémnou rozpustnosťou vo vode, takže tvorí hydraty, absorbuje vlhkosť a je vynikajúca. Preto je veľmi ľahké pripraviť jeho vodné roztoky, ktoré slúžia ako zdroj fluoridových aniónov pre všetky tie syntézy, kde je potrebné ho začleniť do nejakej štruktúry.
KI sa produkuje reagovaním uhličitanu draselného s kyselinou fluórčiou a produkuje bifluorid draselného (KHF2), ktoré v dôsledku tepelného rozkladu končí spôsobením fluoridu draslíka.
Štruktúra fluoridu draslíka
Horný obrázok ukazuje štruktúru fluoridu draslíka. Fialové gule predstavujú katióny k+, Zatiaľ čo žltkasté gule predstavujú anióny f-.
Všimnite si, že usporiadanie je kubické a zodpovedá štruktúre soli Gema, veľmi podobné konaniach chloridu sodného. Všetky gule sú obklopené šiestimi susedmi, ktoré tvoria oktaedron kf6 alebo FK6, to znamená, každý K+ Je obklopený šiestimi f-, A to isté platí pre naopak.
Už predtým sa uvádza, že KF je hygroskopický, a preto absorbuje vlhkosť životného prostredia. Uvedené usporiadanie by teda zodpovedalo bezvodej forme (bez vody) a nie jej hydrátom, ktoré absorbujú toľko vody, že dokonca solubilizujú a „topí“ (lahôdky).
Môže vám slúžiť: Neón: História, vlastnosti, štruktúra, riziká, použitieHydráty
Kryštalické štruktúry hydrátov sa stávajú menej jednoduchými. Pretože teraz molekuly vody zasahujú priamo do usporiadania a interagujú s K iónmi+ a f-. Jedným z najstabilnejších hydrátov je KF · 2H2O y kf · 4h2Ani.
V obidvoch hydrátoch sú novo spomínané oktaedra zdeformované kvôli molekulám vody. Je to hlavne kvôli vodíkovým mostom medzi f- a h₂o (f--Hoh). Kryštalografické štúdie určili, že napriek tomu tieto dva ióny naďalej udržiavajú rovnaký počet susedov.
Výsledkom je, že pôvodná kubická štruktúra pre bezvodú fluór draselného.
Anhydros zdieľajú lahôdku.
Vlastnosti fluoridu draselného
- Molekulová hmotnosť: 58 097 g/mol.
- Fyzický vzhľad (farba): Biele kubické kryštály alebo lahôdkové kryštalické prach.
- Príchuť: Akútna príchuť soľného roztoku.
- Bod varu: 2.741 ° F pri 760 mmHg (1502 ° C). V kvapalnom stave sa stáva vodičom elektriny, hoci anióny môžu- V rovnakej miere nesúhlaste s jazdou ako K+.
- Bod topenia: 1.576 ° F; 858 ° C; 1131 K (KF Anhidro). To svedčí o jeho silných iónových väzbách.
- Rozpustnosť: Rozpustný v HF, ale nerozpustný v alkohole. To ukazuje, že vodík sa premosťuje medzi fluoridom a alkoholmi, f--Hor, nepredporujú proces solvaácie proti rozpúšťaniu jej kryštalickej siete.
- Rozpustnosť vo vode: bezvodý 92 g/100 ml (18 ° C); 102 g/100 ml (25 ° C); Dihydrared 349,3 g/100 ml (18 ° C). To znamená, že keď sa KF hydratuje, stáva sa rozpustnejším vo vode.
- Hustota: 2,48 g/cm3.
- Tlak vodnej pary: 100 kPa (750 mm Hg) pri 1.499 ° C.
- Rozklad: Keď je zahrievaný na rozklad, emituje toxický dym z oxidu draselného a fluoridu vodíka.
- Žieravá akcia: Vodný roztok koroduje sklo a porcelán.
- Bod vzplanutia: Nie je to horľavá látka
- Experimentálny index lomu (ηD): 1.363.
- Stabilita: stabilný, ak je chránený pred vlhkosťou, pretože inak sa tuhá látka rozpustí. Nezlučiteľné so silnými kyselinami a základňami.
Používa fluorid draselný
- Upraviť pH: Vodné roztoky fluoridu draselného sa používajú v priemyselných aplikáciách a procesoch. Napríklad roztoky KF umožňujú prispôsobenie pH vo výrobkoch, ktoré sa vykonávajú v textilnom spracovaní a práčovni (približujú sa hodnote 7).
- Fluór: Fluorid draselný je po fluoridu vodíka hlavným zdrojom získania fluoridu. Tento prvok sa používa v jadrových rastlinách a pri výrobe anorganických a organických zlúčenín, niektoré s použitím, ako je ich začlenenie do dentifriques.
- Syntéza fluórokarbónov: Fluorid draselného sa môže použiť pri syntéze fluorbónu alebo fluorkarbidu z chlorecarbónu pomocou finkeisteínovej reakcie. V tejto reakcii sa ako rozpúšťadlá používajú etylénglykol a dimetylsulfoxid.
- Fluorinácia: Rovnako ako zdroj fluóru, kde leží rozpustený vo vode, z ich roztokov môžu syntetizovať komplexné fluoridy, to znamená, že sú začlenené do F- do štruktúr. Príklad je v nasledujúcej chemickej rovnici:
Mnbr2(ac) + 3kf (ac) => kmnf3(s) + 2 kbr (ac)
- Potom vyzráža zmiešaný fluorid KMNF3. Tak, F by sa mohol pridať- byť súčasťou komplexnej kovovej soli. Okrem mangánu sa môžu ponáhľať fluoridy iných kovov: KCOF3, KFEF3, Noža3, Kcf3 a kznf3.
- Podobne môže byť fluorid kovalentne začlenený do aromatického kruhu, ktorý syntetizuje organizáciu.
- Niekoľko: KF sa používa ako medziprodukt alebo surové materiály pre syntézu zlúčenín, ktoré sa používajú hlavne v agrochémii alebo výrobkoch z pesticídov.
- Okrem toho sa používa ako zakladajúci činidlo Weld.
Odkazy
- Fluorid draslíka. Obnovené z chemickej knihy.com.
- Fluorid draslíka. Obnovený z pubchem.Ncbi.NLM.NIH.Vláda.

