Štruktúra fluoridu horečnatý, vlastnosti, syntéza, použitie
- 2908
- 30
- Ing. Ervín Petruška
On Horčík Je to bezfarebná anorganická soľ, ktorej chemický vzorec je mgf₂. Nachádza sa v prírode ako minerál Sealíta. Má veľmi vysoký bod fúzie a vo vode je veľmi málo rozpustný. Je relatívne inertná, pretože napríklad jej reakcia na kyselinu sírovú je pomalá a neúplná a odoláva hydrolýze s kyselinou fluórovou (HF) až 750 ° C.
Je to zlúčenina, ktorá má byť ovplyvnená vysokovýkonným žiarením. Okrem toho má nízky index lomu, vysoký odpor korózie, dobrú tepelnú stabilitu, významnú tvrdosť a vynikajúce vlastnosti prenosu viditeľného svetla, UV (ultrafialové) a IR (infračervené).

Tieto vlastnosti majú vynikajúci výkon v optickom poli a navyše z neho robia užitočný materiál, ako je podpora katalyzátora, poťahovací prvok, protireflexné šošovky a okná pre infračervený prenos, okrem iných aplikácií.
[TOC]
Štruktúra
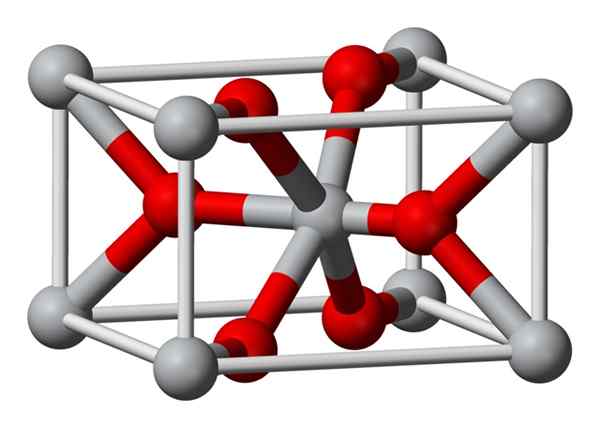
Kryštalická štruktúra fluoridu horčíka pripravená chemicky je rovnaký ako štruktúra prírodného minerálu sellaíta. Kryštalizuje v dipiramidálnej triede tetragonálneho systému.
Ióny horčíka (mg2+) sa nachádzajú v tetragonálnom zameranom na vesmír, zatiaľ čo fluoridové ióny (F-) sa nachádzajú v rovnakej rovine svojich susedov MG2+ a sú spojené s nimi, zoskupené v pároch s každým. Vzdialenosť medzi MG2+ a F-iónmi je 2,07 Á (Angstroms) (2,07 x 10-10M).
Jeho kryštalická koordinácia je 6: 3. To znamená, že každý ión Mg2+ je obklopený 6 iónmi f- a každý ión f- je zase obklopený 3 mg2+ 5 iónmi.
Štruktúra je veľmi podobná štruktúre minerálu Rutilo, ktorý je prírodnou formou oxidu titaničitého (Ti02), s ktorým má spoločné niekoľko krytografických vlastností.
Počas jeho získania fluorid horčíka sa nezráža vo forme amorfnej tuhej látky, pretože Mg2+ a F-ióny nemajú tendenciu tvoriť polymérne komplexy v roztoku.
Vlastnosti
Je zaujímavé zdôrazniť, že fluorid horčíka je dvojfrinujúci materiál. Toto je optická vlastnosť, ktorá vám umožňuje rozvinúť lúč dopadajúceho svetla do dvoch samostatných lúčov, ktoré sa šíria rôznymi vlnkami a vlnovými dĺžkami.
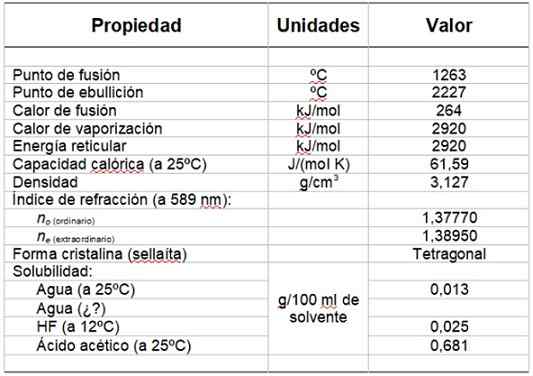
Môže vám slúžiť: hydroxylová skupinaTabuľka 1 ukazuje niektoré z jeho vlastností.
stôl 1. Fyzikálne a chemické vlastnosti fluoridu horčíka.
Syntéza a príprava
Môže sa pripraviť niekoľkými spôsobmi, medzi ktorými možno spomenúť nasledujúce:
1-pretože reakcia medzi oxidom horečnatý (MGO) alebo uhličitanom horečnatý (MGCO3) s kyselinou fluoridovou kyselinou (HF) 2:
MGO + 2 HF MGF2 + H2O
MGCO3 + 2 HF MGF2 + CO2 + H2O
2-pre reakciu medzi uhličitanom horečnatý a bifluóruom amónnym (NH4HF2), obidve v tuhom stave, pri teplote medzi 150 a 400 ° C2:
150-400 ° C
MgCO3 + NH4HF2 MGF2 + NH3 + CO2 + H2O
3-kalento Vodný roztok uhličitanu horečnatého a fluoridu amónneho (NH4F) v prítomnosti hydroxidu amónneho (NH4OH) pri 60 ° C 2:
60 ° C, NH4OH
MgCO3 + 3 NH4F NH4MGF3 + (NH4) 2CO3
Zrazenina fluoridu amónneho a horečnatého (NH4MGF3) sa potom zahrieva na 620 ° C počas 4 hodín, aby sa získal fluorid horečnatý:
620 ° C
NH4MGF3 MGF2 + NH3 + HF
4- ako vedľajší produkt získavania berylia (BE) a uránu (u). Fluorid požadovaného prvku s kovovým horčíkom sa zahrieva v taviaceho hrnca s mgf22::
Bef2 + mg be + mgf2
5-HACKOVÝ REAKTOVÝ Chlorid horčíka (MGCL2) s fluoridom amónneho (NH4F) vo vodnom roztoku pri teplote miestnosti 3:
25 ° C, H2O
MGCL2 + 2 NH4F MGF2 + 2NH4CL
Keďže metódy prípravy MGF2 sú drahé, existujú pokusy o ich ekonomickejšie, medzi ktorými je spôsob výroby z morskej vody.
Môže vám slúžiť: Hydrid vápenatý (CAH2): Vlastnosti, reaktivita a použitieToto sa vyznačuje pridaním dostatočného fluoridového iónov (F-) do morskej vody, ktorá má hojnú koncentráciu iónov horčíka (Mg2+), čím uprednostňuje zrážanie MGF2.
Optické kryštály fluoridu horčíka sa získavajú tlakom horúceho z vysoko kvalitného MGF2, získané napríklad metódou NH4HF2.
Existuje mnoho techník na prípravu materiálov na fluorid horčíka, ako je rast jedného skla, spekanie (zhutnenie do formy alebo tvaru) bez tlaku, horúce a spekanie stlačené mikrovlnnou rúrou.
Žiadosti
Optika
Kryštály MGF2 sú vhodné pre optické aplikácie, pretože sú priehľadné z oblasti UV oblasti do priemernej oblasti IR 2,10.
Ako inertný film sa používa na zmenu vlastností prenosu svetla optických a elektronických materiálov. Jednou z hlavných aplikácií je technológia VUV Optics for Space Exploration Technology.
Vďaka svojej vlastnosti pre potápanie je tento materiál užitočný v polarizačnej optike, v laserových oknách a hranoloch ecimerov (ultrafialový laserový typ používaný v očnej chirurgii).
Je potrebné poznamenať, že fluorid horečnatý používaný pri výrobe optických materiálov tenkého filmu musí byť bez nečistôt alebo zlúčenín, ktoré sú zdrojom oxidu, ako je voda (H2O), hydroxidové ióny (OH-), uhličitanové ióny (CO3 = ), Sulfátové ióny (SO4 =) a podobné 12.
Katalýza alebo zrýchlenie reakcií
MGF2 sa úspešne použil ako katalyzátorová podpora na reakciu eliminácie chlóru a pridanie vodíka do CFC (chlórfluórokarbóny), dobre známe chladivá a aerosólové hnacie látky a zodpovedné za poškodenie atmosféry ozónovej vrstvy.
Výsledné zlúčeniny, HFC (hydrofluorokarbóny) a HCFC (hydrochlorofluórokarbóny), nepredstavujú tento škodlivý účinok atmosfére 5.
Bola tiež užitočná ako podpora katalyzátorov pre hydrodesulfráciu (eliminácia síry) organických zlúčenín.
Môže vám slúžiť: Chemická rovnováha: Vysvetlenie, faktory, typy, príkladyIné použitia
Materiály generované grafitmi, fluórmi a mgf2 prechádzajú.
Eutctic vytvorený NAF a MGF2 predstavuje vlastnosti ukladania energie v latentnom teple, takže sa považuje za použitie v systémoch solárnej energie.
V oblasti biochémie sa fluorid horčíka spolu s ďalšími kovovými fluoridmi používa na inhibíciu reakcií prenosu fosforyl v enzýmoch.
Nanesiatky MGF2 boli nedávno úspešne testované ako vektory umiestňovania liečiva v chorých bunkách na liečbu rakoviny.
Odkazy
- Buckley, h.A. a Vernon, w.Siež. (1925) XCIV. Kryštálová štruktúra fluoridu horčíka. Filozofické časopisy Series 6, 49: 293, 945-951.
- Kirk-Othmer (1994). Encyklopédia chemickej technológie, zväzok 11, piate vydanie, John Wiley & Sons. ISBN 0-471-52680-0 (v.jedenásť).
- Peng, Minhong; Cao, Weiping; a pieseň, Jinhong. (2015). Príprava priesvitnej keramiky MGF2 pomocou horúceho spekania. Journal of Wuhan University of Technology-Mater: SCI. Edimatizovať. Zvuk. 30 Nie. 4.
- „.С. (2011). Fluoridový horčík. Zdroj: Vlastná práca.
- Wojciechowska, Maria; Zielinski, Michal; a Piettowski, Mariusz. (2003). MGF2 ako nekonfvenčná podpora katalyzátora. Journal of Fluorine Chemistry, 120 (2003) 1-11.
- Korth Kristalle GmbH. (2019). Fluorid horčík (MGF2). Konzultovalo sa 07/12/2019 v: Korth.z
- Sevonkaev, Igor a Matijevic, Egon. (2009). Tvorba častíc fluoridu horčíka s rôznymi morfológiami. Langmuu 2009, 25 (18), 10534-10539.
- „.С. (2013). Fluoridový horčík. Zdroj: Vlastná práca.
- Tao Qin, Peng Zhang a Weiwei Qin. (2017). Nová metóda syntetizácie nízkonákladových guorov horčíkových fluoridov z morskej vody. Ceramics International 43 (2017) 14481-14483.
- Ullmannova encyklopédia priemyselnej chémie (1996) Piate vydanie. Zväzok A11. VCH Verlagsgellschaft MBH. New York. ISBN 0-89573-161-4.
- NASA (2013). Inžinieri kontrolujú primárne zrkadlo Hubble Space Telescope 8109563. Zdroj: Mix.MSFC.hrniec.Vláda
- « Pictografický pôvod, charakteristiky a príklady
- Charakteristiky a príklady komerčných transakcií »

