Faktory, ktoré ovplyvňujú rozpustnosť
- 5077
- 548
- Mgr. Pravoslav Mokroš
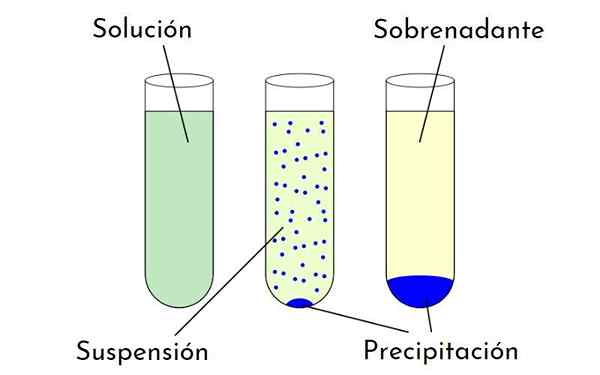
 Diagram, ktorý ukazuje rozdiely medzi roztokom, suspenziou a zrážkami, ktoré tvoria zrazeninu a supernatant. Zdroj: Zabmilenko: orninalzofari: vektormrmw: optimalizovaný, multilang, wikimedia commons
Diagram, ktorý ukazuje rozdiely medzi roztokom, suspenziou a zrážkami, ktoré tvoria zrazeninu a supernatant. Zdroj: Zabmilenko: orninalzofari: vektormrmw: optimalizovaný, multilang, wikimedia commons Aké sú faktory, ktoré ovplyvňujú rozpustnosť?
Hlavná Faktory, ktoré ovplyvňujú rozpustnosť Sú to polarita, účinok spoločného iónu, teploty, tlaku, povahy rozpustenej látky a mechanických faktorov. Rozpustnosť je schopnosť tuhej, kvapalnej alebo plynnej chemikálie (nazývanej rozpustená látka) rozpustiť v rozpúšťadle (zvyčajne kvapalina) a tvoriť roztok.
Rozpustnosť látky v zásade závisí od použitého rozpúšťadla, ako aj od teploty a tlaku. Rozpustnosť látky v konkrétnom rozpúšťadle sa meria koncentráciou nasýteného roztoku.
Roztok sa považuje za nasýtený, keď pridanie ďalšej rozpustenej látky už nezvyšuje koncentráciu roztoku.
Stupeň rozpustnosti sa veľmi líši v závislosti od látok, od nekonečne rozpustných (úplne miešateľných), ako je etanol vo vode, až po malé rozpustné, ako strieborný chlorid vo vode. Termín „nerozpustný“ sa často vzťahuje na malé rozpustné zlúčeniny.
Niektoré látky sú rozpustné vo všetkých pomeroch s daným rozpúšťadlom, ako je etanol vo vode. Táto vlastnosť je známa ako miešajúca sa.
Za rôznych podmienok je možné prekonať rovnovážnu rozpustnosť, aby sa poskytlo riešenie nazývané presýtené.
Hlavné faktory, ktoré ovplyvňujú rozpustnosť
1. Polarita
Vo väčšine prípadov rozpustene rozpúšťajú rozpúšťadlá, ktoré majú podobnú polaritu. Chemici používajú populárny aforizmus na opis tejto charakteristiky rozpustených látok a rozpúšťadiel: „Podobné rozpúšťajú podobné“.
Non -Polar Solutes sa nerozpúšťajú v polárnych rozpúšťadlách a naopak.
2. Spoločný iónový efekt
Bežný iónový účinok je termín, ktorý opisuje zníženie rozpustnosti iónovej zlúčeniny, keď soľ obsahuje ión, ktorý už existuje v chemickej rovnováhe, sa pridá do zmesi.
Tento efekt je najlepšie vysvetliť princíp Le Châtelier. Predstavte si, že zlúčenina sulfát vápenatého mierne rozpustný, puzdro4, Pridáva sa do vody. Čistá iónová rovnica pre výslednú chemickú rovnováhu je nasledovná:
Case4 (S) ⇌CA2+(aq)+SO42- (aq)
Síran vápnika je mierne rozpustný. V rovnováhe väčšina vápnika a síranu existuje pevne sulfát vápenatého.
Môže vám slúžiť: Kyselina iahydrová (HI): Štruktúra, vlastnosti a použitiaPredpokladajme, že iónová zlúčenina rozpustný sulfát medi (CUO4) Bol pridaný do riešenia. Sulfát medi je rozpustný. Jeho jediným dôležitým účinkom na čistú iónovú rovnicu je preto pridanie viac sulfátových iónov (tak42-).
Cuso4 (s) ⇌CU2+(aq)+SO42- (aq)
Disociované sulfátové ióny sulfátu medi sú už prítomné (bežné A) v zmesi z miernej disociácie sulfátu vápenatého.
Preto toto pridanie sulfátových iónov zdôrazňuje predtým stanovenú rovnováhu.
Princíp Le Catelier diktuje, že dodatočné úsilie na tejto strane vyváženého produktu vedie k zmene rovnováhy na strane reaktantov na zmiernenie tohto nového napätia.
V dôsledku zmeny na reagujúcu stranu sa rozpustnosť rozpustného sírana vápenatého ďalej znižuje.
3. Teplota
Teplota má priamy vplyv na rozpustnosť. Pre väčšinu iónových tuhých látok zvýšenie teploty zvyšuje rýchlosť, s akou je možné roztok vyrobiť.
Keď sa teplota zvyšuje, tuhé častice sa pohybujú rýchlejšie, čo zvyšuje možnosti interakcie s viacerými časticami rozpúšťadla. To má za následok zvýšenie rýchlosti, pri ktorej sa roztok vyskytuje.
Teplota môže tiež zvýšiť množstvo rozpustenej látky, ktorú je možné rozpustiť v rozpúšťadle. Vo všeobecnosti, keď sa teplota zvyšuje, sa rozpustí viac rozpustených častíc.
Napríklad, keď sa cukor pridáva do vody, je ľahká metóda na vytvorenie riešenia. Keď sa tento roztok zahrieva a stále sa pridáva cukor, zistilo sa, že sa môže pridať veľké množstvo cukru, keď sa teplota naďalej zvyšuje.
Dôvod, prečo sa to stane, je to, že s rastúcou teplotou sa môžu intermolekulárne sily ľahšie rozbiť, čo umožňuje prilákanie väčších častíc rozpustených častíc do rozpúšťadiel častíc rozpúšťadla.
Môže vám slúžiť: horčík: história, štruktúra, vlastnosti, reakcie, použitieExistujú však ďalšie príklady, keď zvýšenie teploty má veľmi malý vplyv na množstvo rozpustenej látky, ktorú je možné rozpustiť.
Stolová soľ je dobrým príkladom: v ľadovej vode môžete rozpustiť takmer rovnaké množstvo stolovej soli, akú môžete vo vriacej vode.
Pre všetky plyny, keď sa teplota zvyšuje, rozpustnosť klesá. Na vysvetlenie tohto javu sa môže použiť kinetická molekulárna teória.
Keď sa teplota zvyšuje, molekuly plynu sa pohybujú rýchlejšie a sú schopné uniknúť z tekutiny. Rozpustnosť plynu teda klesá.
4. Tlak
Štvrtý faktor, tlak, ovplyvňuje rozpustnosť plynu v kvapaline, ale nikdy z pevnej látky, ktorá sa rozpúšťa v kvapaline.
Ak sa tlak vyvíja na plyn, ktorý je nad povrchom rozpúšťadla, plyn sa presunie do rozpúšťadla a zaberá niektoré priestory medzi časticami rozpúšťadla.
Dobrým príkladom je sýtená sóda. Tlak sa vyvíja na silu molekúl v sóde. Opak je tiež pravdivý. Keď sa znižuje tlak plynu, rozpustnosť tohto plynu tiež klesá.
Keď sa otvorí nápoj s sódovým nápojom, tlak v sóde sa zníži, takže plyn sa okamžite začne dostať z roztoku.
Oxid uhličitý uložený v sóde sa uvoľňuje a na povrchu kvapalného povrchu môžete vidieť šumivo. Ak je otvorená plechovka sódy ponechaná na určitý čas, môžeme si všimnúť, že nápoj sa z dôvodu straty oxidu uhličitého stane plochý.
Tento tlakový faktor plynu je vyjadrený podľa Henryho zákona. Henryho zákon ustanovuje, že pri danej teplote je rozpustnosť plynu v kvapaline úmerná čiastočnému tlaku plynu na kvapalinu.
Môže vám slúžiť: Normálne riešenia: Koncept, príprava, príkladyPríklad Henryho zákona sa vyrába pri potápaní. Keď sa človek ponorí do hlbokej vody, tlak sa zvyšuje a viac plynov sa rozpustí v krvi.
Zatiaľ čo stúpajú z hlbokej vody, potápač sa musí vrátiť na povrch veľmi pomalou rýchlosťou, aby sa všetkým rozpusteným plynom umožnilo veľmi pomaly opustiť krv.
Ak osoba vystúpi príliš rýchlo, môže dôjsť k lekárskej pohotovosti v dôsledku plynov, ktoré vychádzajú z krvi príliš rýchlo.
5. Povaha
Povaha rozpustenej látky a rozpúšťadla a prítomnosť iných chemických zlúčenín v roztoku ovplyvňujú rozpustnosť.
Napríklad môžete rozpustiť väčšie množstvo cukru vo vode, ktoré vyjde vo vode. V tomto prípade sa hovorí, že cukor je rozpustnejší.
Etanol vo vode je navzájom úplne rozpustný. V tomto konkrétnom prípade bude rozpúšťadlom zlúčeninou, ktorá je vo väčšom množstve.
Veľkosť rozpustenej látky je tiež dôležitým faktorom. Čím väčšie sú molekuly rozpustenej látky, tým väčšia je jeho molekulová hmotnosť a jej veľkosť. Pre molekuly rozpúšťadla je ťažšie obklopovať väčšie molekuly.
Ak sú vylúčené všetky vyššie uvedené faktory, je možné zistiť, že najväčšie častice sú vo všeobecnosti menej rozpustné.
Ak sú tlak a teplota rovnaké ako medzi dvoma rozpustenými látkami tej istej polarity, ten, ktorý má menšie častice, je zvyčajne rozpustnejší.
6. Mechanické faktory
Na rozdiel od rýchlosti roztoku, ktorá závisí hlavne od teploty, rýchlosť rekryštalizácie závisí od koncentrácie rozpustenej látky na povrchu kryštalickej siete, čo je prípad, ktorý je uprednostňovaný, keď je roztok nehybné.
Preto agitácia roztoku sa vyhýba tejto akumulácii, čo maximalizuje roztok.
Odkazy
- Rozpustnosť. Získané z hraníc.com.
- Faktory, ktoré prchajú rozpustnosť. Zotavené z CK12.orgán.
- Vzdelávanie online (s.F.). Faktory, ktoré prchajú rozpustnosť. Zdroj z rozpustnosti.com.

