Štruktúra faktora nekrózy nádoru (TNF), mechanizmus účinku, funkcia
- 687
- 135
- Václav Višňovský
On Faktor nekrózy nádoru (TNF), tiež známy ako caquectín, je prirodzene produkovaný proteín vo fagocytárnych alebo makrofágových bunkách ľudského tela a iných cicavčích zvierat. Je to veľmi dôležitý cytoquín, ktorý sa podieľa na normálnych fyziologických procesoch, ako aj na rozmanitosti patologických procesov tela.
Jeho objav pochádza z niečo pred viac ako 100 rokmi, keď w. Coley použil surové bakteriálne extrakty na liečbu nádorov u rôznych pacientov a zistil, že tieto extrakty mali schopnosť indukovať nekrózu týchto nádorov, pričom spustili systémovú zápalovú reakciu u pacientov.
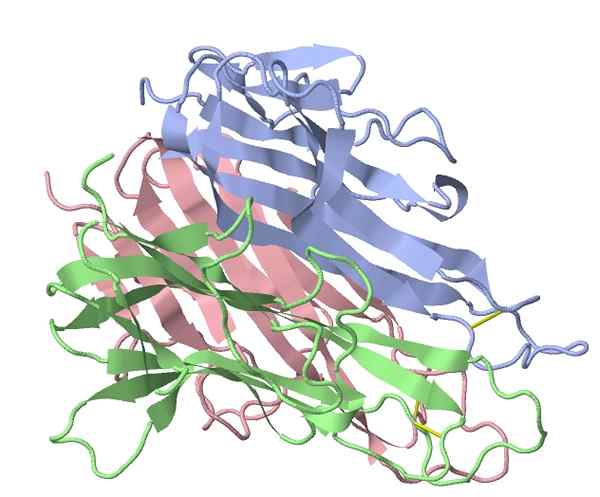
 Nekróza nádorovej nekrózy alfa myšací faktor (Zdroj: TK Vallery/CC BY-SA (https: // creativeCommons.Org/licencie/By-SA/3.0) Via Wikimedia Commons)
Nekróza nádorovej nekrózy alfa myšací faktor (Zdroj: TK Vallery/CC BY-SA (https: // creativeCommons.Org/licencie/By-SA/3.0) Via Wikimedia Commons) Hlavný „prozápalový“ stimulátor aktivovaný bakteriálnymi extraktmi používanými Coleyom bol identifikovaný v roku 1975, čo dokazuje, že proteínový faktor v sére liečených pacientov spôsobil nádorovú lýzu, kde názov, ktorý identifikuje túto skupinu tejto skupiny, vznikajú proteíny (TNFF (TNFF. -α).
Približne o 10 rokov neskôr, v roku 1984, bol izolovaný a charakterizovaný gén „nekrózy nádorového nekrózy“ a v rovnakom dátume sa izoloval a čistil v T lymfocytoch, ktoré sa nazývali „T alfa t lymfotoxín“ (TLA), ktorý bol následne známy ako faktor TNF-P.
V súčasnosti boli definované početné proteíny podobné pôvodne opísaným TNF, ktoré tvoria TNF proteínovú rodinu (typ nekroózy nádoru) a vrátane TNF-a, TNF-P proteíny, ligand CD40 (CD40L), Ligand Fas ( Fasl) a mnoho ďalších.
[TOC]
Štruktúra
Na úrovni génu
Kódujúci gén pre proteín TNF-a sa nachádza v chromozóme 6 (chromozóm 17 u hlodavcov) a ten, ktorý kóduje proteín TNF-P, predchádza predchádzajúcemu v oboch prípadoch (ľudské aj hlodavce). Tieto dva gény sú v jednej kópii a majú približnú veľkosť 3 kb.
Vzhľadom na skutočnosť, že sekvencia zodpovedajúca podporujúcej oblasti génu TNF-a má niekoľko miest Únie pre transkripčný faktor známy ako „jadrový faktor Kappa B“ (NF-KB), mnohí autori sa domnievajú, že ich expresia závisí od toho, že závisí od toho, že ich expresia závisí od toho tento faktor.
Na druhej strane promótorová oblasť génu TNF-P má sekvenciu spojenia pre ďalší proteín známy ako „skupina s vysokou mobilitou 1“ (HMG-1 z angličtiny, z angličtiny Skupina s vysokou mobilitou 1).
Môže vám slúžiť: myosín: Charakteristiky, štruktúra, typy a funkciaNa úrovni proteínov
Boli opísané dve formy faktora nekrózy nádoru ALFA, ktorá je spojená s membránou (MTNF-a) a druhá, ktorá je vždy rozpustná (STNF-a). Na druhej strane faktor nekrózy beta nádoru existuje iba v rozpustnej forme (STNF-β).
U ľudí sa membránsky tvar TNF-a pozostáva z polypeptidu s viac ako 150 aminokyselinovým odpadom, ktorý je pripojený k „vedúcej“ sekvencii 76 ďalších aminokyselín. Má zjavnú molekulovú hmotnosť asi 26 kDa.
Translokácia tohto proteínu do membrány sa vyskytuje počas jeho syntézy a táto forma je „prevedená“ na rozpustnú formu (17 kDa) enzýmom známym ako „konvertový enzým TNF-a“, schopný transformovať MTNF-a na STNF na STNF -α.
Mechanizmus akcie
Proteíny patriace do skupiny faktorov nádorovej nekrózy (TNF) vyvíjajú svoje funkcie hlavne vďaka ich spojení s špecifickými receptormi v bunkách ľudského tela a iných zvierat.
Existujú dva typy receptorov pre TNF proteíny v plazmatických membránach väčšiny telových buniek, s výnimkou erytrocytov: receptory typu I (TNFR-55) a receptory typu II (TNFR-75).
Oba typy receptorov zdieľajú štrukturálnu homológiu vzhľadom na miesto extracelulárneho únie pre proteíny TNF a tiež sa na ne viažu s ekvivalentnou afinitou. Vtedy sa líšia vo vnútrobunkových signálnych trasách, ktoré sa aktivujú, keď dôjde k procesu väzby ligand-receiver.
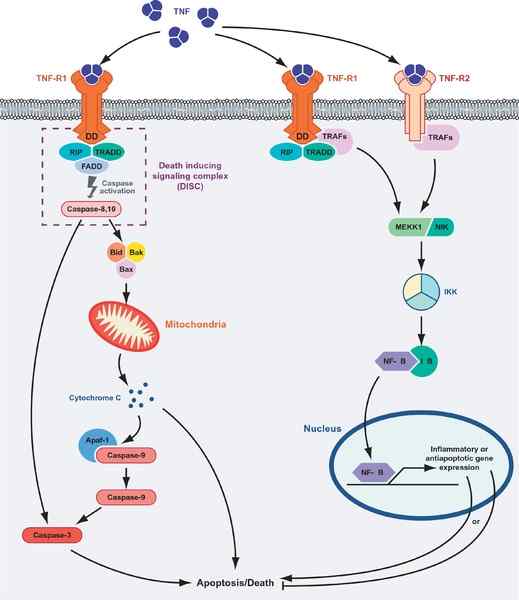 Bunková smrť alebo prežitie sprostredkované proteínmi TNF. Naľavo od grafiky je znázornená apoptotická cesta a trasa „prežitie“ (zdroj: Masmudur M. Rahman, Grant McFadden/CC od (https: // creativeCommons.Org/licencie/o/1.0) Via Wikimedia Commons)
Bunková smrť alebo prežitie sprostredkované proteínmi TNF. Naľavo od grafiky je znázornená apoptotická cesta a trasa „prežitie“ (zdroj: Masmudur M. Rahman, Grant McFadden/CC od (https: // creativeCommons.Org/licencie/o/1.0) Via Wikimedia Commons) Interakcia ligand-receptor TNF s ktorýmkoľvek z jeho receptorov podporuje spojenie troch receptorov do rozpustného triméru TNF-a (trimerizácia receptorov) a uvedená interakcia spúšťa bunkové reakcie, aj keď iba 10% receptorov je obsadený.
Únia v receptoroch typu I
Únia ligand-receptor s receptormi typu I slúži ako „náborová platforma“ iných signalizačných proteínov v cytosolických doménach receptorov (vnútorná časť). Medzi týmito proteínmi je prvý „Get“ TradD alebo proteínový proteín s doménou smrti spojenou s receptorom TNFR-1 (angličtina Proteín domény smrti spojený s TNFR-1).
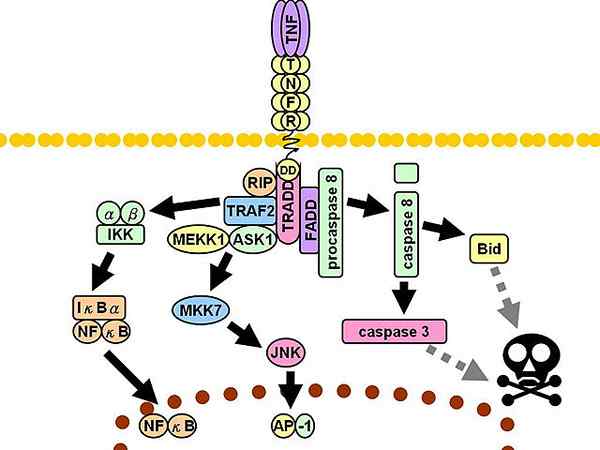 TNFR1 signalizačná trasa. Discontinuálne sivé čiary predstavujú viac krokov.
TNFR1 signalizačná trasa. Discontinuálne sivé čiary predstavujú viac krokov. Následne sa prijímajú ďalší traja sprostredkovatelia: Interakčný proteín s prijímačom 1 (RIP1, z angličtiny Proteín 1 prijímača), Proteín s doménou smrti spojené s FAS (FADD, angličtina Proteín domény smrti spojený s FAS) a faktor 2 spojený s prijímačom TNF (TRAF2, angličtina Faktor 2 spojený s receptorom TNF).
Môže vám slúžiť: fenylalanín: charakteristiky, funkcie, biosyntéza, jedloReceptory typu II
Keď sa TNF viaže na receptory typu II, vedie to k priamemu náboru proteínu TRAF2, ktorý zase prijíma proteín TRAF1. Tieto proteíny aktivujú proteínové trasy MAPK (z angličtiny Proteínkináza aktivovaná mythogénmi), veľmi dôležité z intracelulárneho signalizačného hľadiska v eukaryotoch.
Mnoho signálnych trás, ktoré sú aktivované po spojení faktorov TNF do ich receptorov.
Funkcia
Proteín TNF-a sa produkuje hlavne makrofágmi imunitného systému, zatiaľ čo TNF-P proteín je produkovaný T lymfocytmi. Ukázalo sa však, že tieto faktory tiež produkujú aj iné bunky tela, hoci v menšej miere.
Faktor nekrózy nádoru sa veľmi študoval z hľadiska jeho dôsledkov v normálnych fyziologických procesoch, ako aj v akútnych a chronických zápalových patologických procesoch, pri autoimunitných chorobách a pri zápalových procesoch súvisiacich s rôznymi typmi rakoviny.
Tieto proteíny sú spojené s rýchlym stratou hmotnosti u pacientov trpiacich akútnymi bakteriálnymi infekciami, ktorí trpia rakovinou a ktoré prechádzajú septickým „stretom“.
Pre faktor nekrózy nádoru boli opísané tri rôzne biologické aktivity:
- cytotoxicita proti nádorovým bunkám
- potlačenie lipoproteínovej lipázy adipocytov (LPL) a
- Redukcia pokojového potenciálu myocytov membrány (svalové bunky).
Membranálny tvar TNF-a podporuje cytotoxicitu a bol zapojený do parakrinných aktivít TNF v určitých tkanivách.
Keď sa vníma stimul ako bakteriálny endotoxín, táto forma je proteolypro aktívny TNF v sére a iných telesných tekutinách.
Môže vám slúžiť: enzým: Prevádzka a príkladyMedzi jeho biologické funkcie môžu proteíny TNF prispievať aj k aktivácii a migrácii leukocytov a leukocytov, ako aj podporovať proliferáciu buniek, diferenciáciu a apoptózu.
Inhibítory
Mnoho liečebných lekárov receptuje inhibítory proteínov TNF na pacientov s autoimunitnými chorobami (liečba anti-TNF). Medzi tieto látky patrí: Infliximab, Etanercept, Adalimumab, Golimumab a Certolizumab Pegol.
Najbežnejšou formou použitia je subkutánne injekcie v stehnách alebo bruchu a praktizuje sa dokonca priama žilová infúzia. Napriek tomu, do akej miery z týchto látok môže pomôcť určitým pacientom, existujú určité nepriaznivé účinky spojené s ich používaním, medzi ktoré patrí zvýšenie rizika sťahovania infekcií, ako je tuberkulóza alebo iné plesňové infekcie.
„Prírodné“ nefarmakologické inhibítory
Niektoré „rezné“ fragmenty proteínov TNF (typu I a typu II) majú tiež známe ako TNF úniové proteíny (TNF-BPS, angličtina Viazaný proteínový faktor nekrózy nádor) boli zistené u moču pacientov s rakovinou, AIDS alebo sepsis.
V niektorých prípadoch tieto fragmenty inhibujú alebo neutralizujú aktivitu proteínov TNF, pretože sa vyhýbajú interakcii ligandového receptora.
V niektorých rastlinných produktoch odvodených z kurkumy a granátu boli detegované ďalšie „prírodné“ inhibítory proteínov TNF, hoci štúdie sa v tomto ohľade stále vykonávajú.
Odkazy
- Baud, v., & Karin, m. (2001). Signálna transdukcia faktorom nekrózy nádoru a jeho príbuznými. Trendy v bunkovej biológii, 11 (9), 372-377.
- Chu, W. M. (2013). Nekróza nádor. Rakovina, 328 (2), 222-225.
- Kalliolias, G. D., & Ivkiv, l. B. (2016). Biológia TNF, patogénne mechanizmy a vznikajúce terapeutické stratégie. Nature Reviews Rheumatology, 12 (1), 49.
- Lis, k., Kuzawińska, alebo., & Bałkowiec -IKRA a. (2014). Inhibítory nekrózy inhibítorov. Archívy lekárskej vedy: AMS, 10 (6), 1175.
- Tracey, MD, K. J., & Cerami, pH. Dávať. (1994). Faktor nádoru nekrózy: pleiototropný cytokín a terapeutický cieľ. Ročný prehľad medicíny, 45 (1), 491-503.
- Wu, h., & Hymowitz, s. G. (2010). Štruktúra a funkcia faktora nekrózy nádoru (TNF) na bunkovom povrchu. V príručke bunkovej signalizácie (str. 265-275). Akademická tlač.
- « Štruktúra fosforečnanu draselného (K3PO4), vlastnosti, použitie
- Aká je teória histórie alebo historiológie? »

