Faktor stlačiteľnosti Ako vypočítať, príklady a cvičenia
- 2440
- 691
- JUDr. Rudolf Čapkovič
On Faktor stlačiteľnosti Z, o Kompresný faktor pre plyny, je bezrozmerná hodnota (bez jednotiek), ktorá sa zavádza ako korekcia v stavom rovnici ideálnych plynov. Týmto spôsobom matematický model pripomína pozorované správanie plynu viac.
V ideálnom plyne je štátna rovnica, ktorá sa týka premenných p (tlak), v (objem) a t (teplota): P.Vložka ideálny = n.R.Tón s n = počet krtkov a r = konštanta ideálnych plynov. Pridanie korekcie kompresívneho faktora Z sa táto rovnica transformuje na:
P.V = z.n.R.Tón
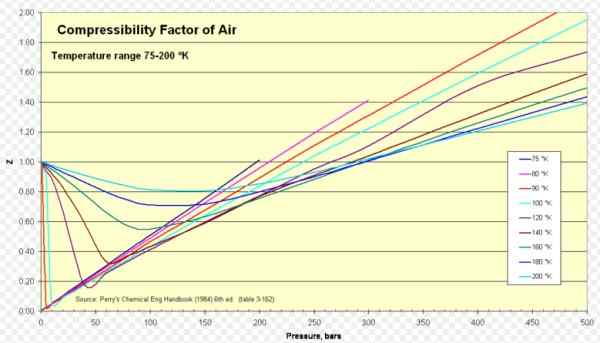
 postava 1. Faktor stlačiteľnosti vzduchu. Zdroj: Wikimedia Commons. https: // nahrávanie.Wikimedia.org/wikipedia/commons/8/84/compressibility_factor_of_air_75-200_k.Png.
postava 1. Faktor stlačiteľnosti vzduchu. Zdroj: Wikimedia Commons. https: // nahrávanie.Wikimedia.org/wikipedia/commons/8/84/compressibility_factor_of_air_75-200_k.Png. [TOC]
Ako vypočítať faktor stlačiteľnosti?
Berúc do úvahy, že molárny objem je Vložkaochladiť = V/n, Máte skutočný molárny objem:
P . Vložkareálny = Z. R. T → z = PV reálny/Rt
Pretože faktor stlačiteľnosti Z závisí od podmienok plynu, vyjadruje sa ako funkcia tlaku a teploty:
Z = z (p, t)
Pri porovnaní prvých dvoch rovníc sa uvádza, že ak sa počet mólov n rovná 1, molárny objem skutočného plynu súvisí s objemom ideálneho plynu cez:
Vložkareálny / Videálny = Z → V reálny = Z Videálny
Keď tlak presahuje 3 atmosféry, väčšina plynov sa prestane správať ako ideálne plyny a skutočný objem sa výrazne líši od ideálneho.
To sa uskutočnilo vo svojich experimentoch Holandský fyzik Johannes van der Waals (1837-1923), čo ho viedlo k vytvoreniu modelu, ktorý sa lepšie prispôsobil praktickým výsledkom ako rovnica ideálnych plynov: štátna rovnica Van der Waals.
Môže vám slúžiť: oxalát sodný (Na2C2O4): Štruktúra, vlastnosti, použitia, rizikáPríklady
Podľa rovnice P.Vložkareálny= Z.n.Rt, Pre ideálny plyn, z = 1. Avšak v skutočných plynoch zvyšuje tlak aj hodnota Z. To dáva zmysel, pretože pri väčších tlakových molekulách plynu majú viac príležitostí na zrážanie, preto sa odpudivé sily zvyšujú, a tým objem.
Na druhej strane do nižších tlakov sa molekuly pohybujú s väčšou voľnosťou a odpudivé sily klesajú. Preto sa očakáva nižší objem. Pokiaľ ide o teplotu, keď sa zvyšuje, Z klesá.
Ako poznamenal Van der Waals, v blízkosti takzvaného kritického bodu je správanie plynu veľmi odklonené od ideálneho plynu.
Kritický bod (tc, Pc) akejkoľvek látky sú hodnoty tlaku a teploty, ktoré určujú ich správanie pred zmenou fázy:
-Tónc Je to teplota nad ktorou nie je daný plyn skvapalnený.
-Pc Je to minimálny tlak potrebný na skvapalnenie plynu pri teplote tc
Každý plyn má však svoj vlastný kritický bod, ale definuje teplotu a znížený tlak tr A pr nasledovne:
Pr = P / pc
Vložkar = V /vc
Tónr = T /tc
Zistilo sa, že plyn obmedzený s identickým Vložkar a Tónr vyvíjať rovnaký tlak Pr. Z tohto dôvodu, ak je z grafický v závislosti od Pr to isté Tónr, Každý bod v tejto krivke je rovnaký pre akýkoľvek plyn. Toto sa volá Zásada zodpovedajúcich štátov.
Faktor stlačiteľnosti v ideálnych plynoch, vzduchu, vodíku a vode
Nižšie je krivka stlačiteľnosti pre rôzne plyny pri rôznych znížených teplotách. Potom niekoľko príkladov z pre niektoré plyny a postup na nájdenie z použitím krivky.
Môže vám slúžiť: Vodík: História, štruktúra, vlastnosti a použitia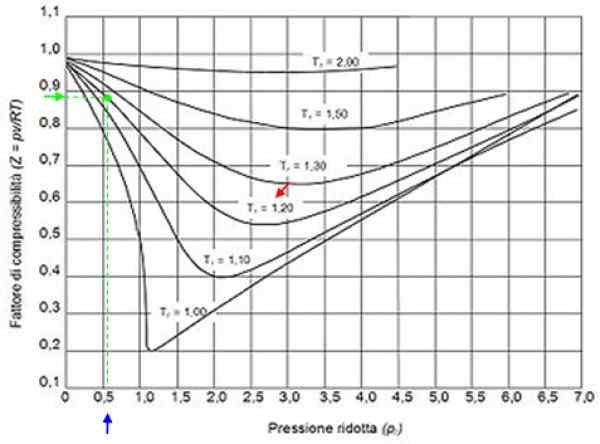 Obrázok 2. Grafická grafika pre plyny podľa redukčného tlaku. Zdroj: Wikimedia Commons.
Obrázok 2. Grafická grafika pre plyny podľa redukčného tlaku. Zdroj: Wikimedia Commons. Ideálne plyny
Ideálne plyny majú z = 1, ako je vysvetlené na začiatku.
Vysielať
Pre vzduch z je približne 1 v rozsiahlom rozsahu teploty a tlakov (pozri obrázok 1), kde ideálny model plynu poskytuje veľmi dobré výsledky.
Vodík
Z> 1 pre všetky tlaky.
Vodná voda
Na nájdenie z vody sú potrebné hodnoty kritického bodu. Kritický bod vody je: Pc = 22.09 MPA a Tc= 374.14 ° C (647.3 k). Opäť je potrebné vziať do úvahy, že faktor stlačiteľnosti Z závisí od teploty a tlaku.
Predpokladajme napríklad, že chcete nájsť Z z vody pri 500 ° C a 12 MPa. Potom je prvým výpočtom zníženej teploty, pre ktorú sa musia Celzia stupne odovzdať do Kelvinu: 50 ° C = 773 K:
Tónr = 773/647.3 = 1.2
Pr = 12/22.09 = 0.54
S týmito hodnotami sa nakladáme v grafe obrázku, krivka zodpovedajúca Tr = 1.2, označené červenou šípkou. Potom sa pozrieme do horizontálnej osi hodnota Pr bližšie k 0.54, označené modrou farbou. Teraz kreslíme zvislú, až kým nezachytíme krivku Tr = 1.2 A nakoniec sa premieta od tohto bodu do vertikálnej osi, kde čítame približnú hodnotu z = 0.89.
Vyriešené cvičenia
Cvičenie 1
Vzorka plynu je pri teplote 350 K a tlak 12 atmosféry, pričom molárny objem o 12 % je vyšší, ako sa predpokladá, že zákon ideálnych plynov. Vypočítať:
A) Z Kompresný faktor.
b) molárny objem plynu.
Môže vám slúžiť: nezvratná reakcia: Charakteristiky a príkladyc) Podľa vyššie uvedených výsledkov naznačte, ktoré sú dominantné sily v tejto vzorke plynu.
Údaje: r = 0,082 l.bankomat/mol.Klimatizovať
Roztok
Vedieť, že v reálny je o 12 % vyššia ako Vložkaideálny :
Vložkareálny = 1.12Videálny
Z = v reálny / Videálny = 1.12
Riešenie B
P . Vložkareálny = Z. R. T → Vreálny = (1.12 x 0.082 x 350/12) l /mol = 2.14 l/mol.
Riešenie c
Odpudkové sily sú sily, ktoré prevládajú, pretože objem vzorky sa zvýšil.
Cvičenie 2
Existuje 10 mólov etánu uväznených v objeme 4.86 L A 27 ° C. Nájdite tlak vyvíjaný etánom z:
a) Model ideálneho plynu
b) Van der Waalsova rovnica
c) Nájdite kompresný faktor z predchádzajúcich výsledkov.
Údaje pre etán
Van der Waals koeficienty:
A = 5.489 dm6. Bankomat . mol-2 a b = 0.06380 dm3. mol-1.
Kritický tlak: 49 bankomat. Kritická teplota: 305 K
Roztok
Teplota sa prenáša na Kelvin: 27 ° C = 27 +273 K = 300 K, nezabudnite tiež, že 1 liter = 1 l = 1 dm3.
Potom sa údaje uvedené v ideálnej plynovej rovnici vymenia:
P.V = n.R.T → p = (10 x 0,082 x 300/4.86 l) bankomat = 50.6 bankomat
Riešenie B
Štátna rovnica van der Waals je:
Kde A a B sú koeficienty uvedené vyhlásením. Pri zúčtovaní p:
Riešenie c
Vypočítame znížený tlak a teplotu:
Pr = 35.2/49 = 0.72
Tónr = 300/305 = 0.98 ≈ 1
S týmito hodnotami sa hľadá hodnota z v grafe na obrázku 2, zistenie, že Z je približne 0.7.
Odkazy
- Atkins, str. 1999. Fyzikálna chémia. Vydanie omega.
- Cengel a. 2012. Termodynamika. 7mamička Vydanie. McGraw Hill.
- Engel, T. 2007. Úvod do fyzikálnej konže: Termodynamika. Pearson.
- Levine, i. 2014. Princípy fyziky chémie. 6. Vydanie. McGraw Hill.
- Wikipedia. Faktor stlačiteľnosti. Zdroj: In.Wikipedia.orgán.

