Štruktúra Europio, vlastnosti, získanie, používanie

- 815
- 49
- Blažej Hrmo
On Európia Je to chemický prvok patriaci k vzácnym Zemom, ktorý predstavuje chemický symbol EÚ a ktorého meno je, evidentne, európskemu kontinentu. Toto je najviac reaktívna z kovov vzácnych zemín, porovnávajúce lítium, vápnik a bária, a preto je jeho mineralogická difúzia veľmi rozptýlená.
Je to jeden z naj zriedkavejších a najdrahších kovov, kvôli všetkým postupom, ktoré sa musia vykonať, aby sa extrahovali bez nečistôt. Fyzicky ukazuje šedivú zlatú žiaru spôsobenú jeho rýchlou oxidáciou, je sotva vystavená vzduchu. Preto je zriedkavo možné ho ukladať svojou autentickou striebornou farbou.
 Oxidovaný europium. Zdroj: Hi-res obrázky chemických prvkov/cc od (https: // creativeCommons.Org/licencie/o/3.0)
Oxidovaný europium. Zdroj: Hi-res obrázky chemických prvkov/cc od (https: // creativeCommons.Org/licencie/o/3.0) Europium je tak reaktívny, že musí byť uložený v ampulkách alebo zapečatených nádobách pod inertnou atmosférou. Dokonca aj ponorený do minerálneho oleja je oxidovaný malým rozpusteným kyslíkom.
Vynikajúcou črtou europia je jeho luminiscencia, najmä pozorovaná vo svojich zlúčeninách s oxidačným číslom +3, ako napríklad USA2Ani3, čo je červený fosfor aplikovaný v nekonečnom elektronických zariadeniach a tiež na vstupenkách na európ, aby sa zabránilo jeho falšovaniu.
[TOC]
Europio objav
Objav Europia bol vytvorený v častiach, počas devätnásteho storočia av rôznych krajinách (Švédsko, Nemecko a Švajčiarsko) európskeho kontinentu. Europium ióny bolo ťažké identifikovať, pretože ich absorpčné spektrá zmiešané s spektrom iných kovov z vzácnych zemín, ako sú Hill, Gadolinium a Lanthej, ako aj so Samarium.
Preto identifikácia a izolácia všetkých týchto kovov ťahali Europium ako nečistotu bez charakterizácie. Napríklad izolácia čistej vzorky Cerio, v roku 1839 Carl Gustav Mosander, mala ako produkt uznanie ďalších nových prvkov: Lantano a Didimio.
Pri štúdiu Didimio a záveru sa dosiahol, že skutočne pozostával zo zmesi ďalších prvkov (prosodymium a Neodymium), objavil sa Samario, ktorý našiel v roku 1879 Paul èmile Lecoq.
Môže vám slúžiť: hydrid hliníka (ALH3): štruktúra, vlastnosti, použitiaNeskôr, v roku 1886, švajčiarsky chemik Jean Charles Galissard vyčistil vzorky Samarium, ktorý našiel gadolinio. Lecoq za rok 1892 už študoval spektrá Gadolinia a spektrum iného nového prvku.
O pätnásť rokov neskôr, v roku 1901, francúzsky chemik Eugène Anatole DeMarcay konečne izoloval tento nový prvok a krstil ho ako Europium na počesť Európy.
Chemická štruktúra europia
Atómy Europia zostávajú zjednotené vďaka kovovému dlhopisu a zúčastňujú sa na ňom elektróny svojich orbitálov 4F a 6S. V dôsledku svojich elektronických charakteristík, atómových rádií a režimu jeho balenia končí Europium prijatím kubickej kryštalickej štruktúry sústredenej na tele (BCC), čo je jedným z najmenej hustých.
Neexistujú žiadne bibliografické zdroje, ktoré by uvádzali ďalší polymorf pre Europio, okrem uvedenej fázy BCC, v rámci iných teplotných rozsahov; Ale pod rôznymi tlakmi.
Napríklad Europium podrobené tlaku takmer 18 GPA prijíma kompaktnú hexagonálnu štruktúru a nakoniec sa transformuje do monoklinickej fázy na vyššie tlaky 31.5 GPA.
Elektronická konfigurácia
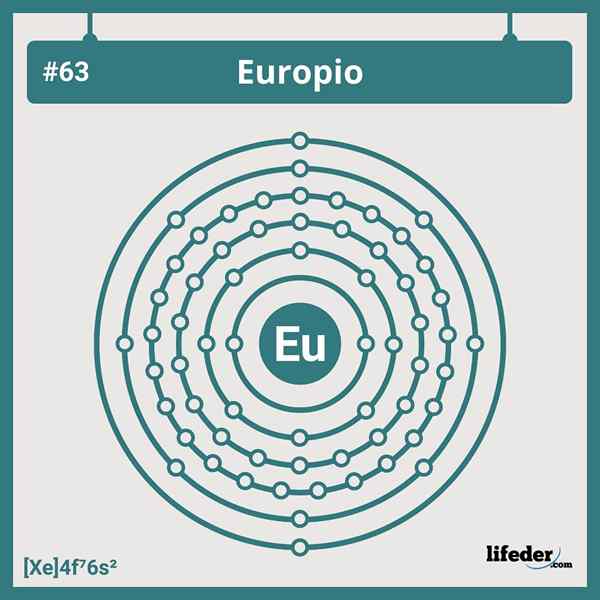 Elektronická konfigurácia europia
Elektronická konfigurácia europia Skrátená elektronická konfigurácia europia je:
[Xe] 6s24f7
Je v pozícii alebo skupine 7 série Lantanide, má sedem elektrónov, ktoré zaberajú svoje orbitály 4F; A preto nezodpovedá žiadnej z odchýlok, ktoré nachádzame v elektronických konfiguráciách pre prvky periodickej tabuľky.
Europio vlastnosti
Fyzický vzhľad
Strieborný biely kov, mäkká tvrdosť podobná ako olovo a ktorá sa zmení na zlato, keď je vystavená vzduchu, pokrýva vrstvu oxidu a uhličitanu.
Atómové číslo
63
Molárna hmota
151.96 g/mol
Bod topenia
826 ° C
Bod varu
1529 ° C
Hustota
Pevné: 5.264 g/cm3
V bode topenia: 5.13 g/cm3
Oxidačné stavy
Hlavné oxidačné stavy europia sú +2 (EÚ2+) a +3 (eu3+), Byť +1 (EÚ+) Najmenej spoločné z troch.
Môže vám slúžiť: Polárny kovalentný odkaz: Charakteristiky a príkladyIonizačné energie
-Prvé: 547.1 kJ/mol (eu+ plyn)
-Po druhé: 1085 kJ/mol (EU2+ plyn)
-Tretie: 2404 kJ/mol (EU3+ plyn)
Elektronegativita
1.2 v Pauling Scale.
Magnetický poriadok
Paramagnetický
Reaktivita
Reaktivita europia je porovnateľná s lítiom, a preto je to najaktatívnejší kov vzácnych zemín. Napríklad rýchlo reagujte s vodou a vytvorte jej zodpovedajúci hydroxid, EÚ (OH)3, žltá, ktorá je na rozdiel od alkalických hydroxidov nerozpustná vo vode:
2 Eu + 6 h2O → 2 Eu (OH)3 + 3 h2
Tiež, keď horí v svetlejšom oxidovanom v USA2Ani3 A prepustil červenkastý plameň, pripomínajúci lítia:
4 Eu + 3 o2 → 2 EÚ2Ani3
Europium je schopný tvoriť mnoho zlúčenín s oxidačným stavom +2, pretože má svoje orbitály F napoly plné (4f7), čo dáva svojmu atómu neobvyklú elektronickú stabilitu.
Eu katión2+ predstavuje chemické správanie podobné správaniu BA2+, Ale na rozdiel od toho pôsobí ako mierne silné redukčné činidlo, oxidáciu USA3+.
Získanie
Surový materiál
Europium je prítomné v mineráloch vzácnych zemín, ako sú bastnasita a monazit. Pretože však udržuje určitú podobnosť s alkalickými a alkalickými kovmi, pokiaľ ide o ich reaktivitu, ich ióny sú veľmi rozptýlené v zemskej kôre vedľa vápnikových minerálov alebo iných kovov, takže neexistuje žiadny minerál sám, že je bohatý na Europium. Preto je vaše získanie veľmi drahé.
Procesy
Eu ióny3+ Sú súčasťou mnohých hrdzavých a fosfátov zriedkavých zemín. Preto je prvým krokom ich oddelenie od ostatných prítomných kovov. Za týmto účelom sú minerály spracované, najmä bastnasit; Dotknú sa, rozpúšťajú sa v silných kyselinách alebo základoch a frakčné zrážky sú podrobené pomocou rôznych reagencií. Podobne sa na oddelenie USA používa chromatografia výmeny iónov3+.
Keď sa minerál spracováva, získa sa koncentrát iónov EÚ3+, ktoré sa dajú znížiť pomocou kovového zinku alebo jeho amalgámu, takže sú redukované na USA2+. Potom USA2+ Coprecita na uhličitanom alebo sírane bária.
Môže vám slúžiť: katalytická hydrogenáciaTáto zrazenina je držaná a podstúpi separáciu na získanie oxidu EÚ2Ani3, ktorý je s Lantano redukovaný v taviacom hrnci Tantalio, aby sa konečne destiloval a kondenzoval kovové europia.
Ďalšou metódou na získanie Europia je vykonanie elektrolýzy zmesi EUCL3 a NaCl alebo CACL2 roztavený. Takto sa vyskytuje chlórový plyn v anóde, zatiaľ čo kovové Europio sa vytvára v katóde.
Použitie/aplikácie
 Červenkastá luminiscencia videná v tomto euro lístku pod UV žiarovkou je spôsobená zlúčeninou Europium. Zdroj: Repro od H. Grobe/CC od (https: // creativeCommons.Org/licencie/o/3.0)
Červenkastá luminiscencia videná v tomto euro lístku pod UV žiarovkou je spôsobená zlúčeninou Europium. Zdroj: Repro od H. Grobe/CC od (https: // creativeCommons.Org/licencie/o/3.0) Europium vo svojej kovovej podobe chýba rutinné použitie. Jeho zlúčeniny sú však ďalším príbehom, najmä jeho oxidom EÚ2Ani3, ktorého fosforescencia bola vyrobená nevyhnutnou súčasťou obrazoviek na zariadeniach, monitoroch a televízoroch. Je to preto, že je to červený fosfor, ktorý vydáva charakteristické červené svetlo.
Červenkastá fosforescencia Europio (III) sa tiež používa na zabránenie falšovania lístkov eur, ktoré sa osvetľujú UV svetlom, aby sa potvrdila jeho legitimita.
Na druhej strane, keď sa zmieša s euro (ii) zlúčeninami, ktoré sú moderné zápasy, získa sa biele svetlo, veľmi opakujúce sa v pohári fluorescenčných žiaroviek.
Europium sa pridáva v malom množstve do hlinitého stroncia, aby sa pripravili fosfory rôznych farieb, ktoré vynikajú za dlhodobú fosforescenciu.
Odkazy
- Triasť a Atkins. (2008). Anorganická chémia. (Štvrté vydanie). MC Graw Hill.
- Národné centrum pre biotechnologické informácie. (2020). Europium. Zhrnutie prvkov pubchem. Získané z: pubchem.Ncbi.NLM.NIH.Vláda
- Wikipedia. (2020). Europium. Zdroj: In.Wikipedia.orgán
- Redaktori Enyclopaedia Britannica. (2020). Europium. Získané z: Britannica.com
- R. J. Manžel a kol. (27. augusta 2012). Europium-IV: Nekomplikovane. Obnovené z: časopisov.APS.orgán
- David. Šokovanie. (26. novembra 2017). Na čo sa používa europium? - Bežné a historické použitie. Štúdium. Získané z: štúdie.com
- DR. Doug Stewart. (2020). Fakty europium prvky. Získané z: Chemicool.com
- « Pôvod, charakteristika monoteizmu, charakteristiky a náboženstvá
- Koncepcia kultúrnych rozdielov a príklady medzi krajinami »

