Etano
- 2512
- 757
- Tomáš Mydlo
 Estano
Estano Čo je etán?
On Etano Je to jednoduchý uhľovodík2H6 S bezfarebnou a toaletnou povahou, ktorá má vysoko cenné a diverzifikované použitie pri syntéze etylénu. Okrem toho je to jeden z pozemných plynov, ktorý bol zistený aj na iných planétach a hviezdnych telách okolo slnečnej sústavy. Objavil ho vedec Michael Faraday v roku 1834.
Medzi veľké množstvo organických zlúčenín tvorených atómami uhlíka a vodíka (známy ako uhľovodíky) sú tie, ktoré sú v plynnom stave pri teplotách a environmentálnych tlakoch, ktoré sa značne používajú v mnohých priemyselných odvetviach.
Zvyčajne pochádzajú z plynnej zmesi nazývanej „zemný plyn“, čo je produkt vysokej hodnoty pre ľudstvo a tvoria medzi inými metán, etán, propán a bután; kvalifikácia podľa množstva atómov uhlíka vo svojom reťazci.
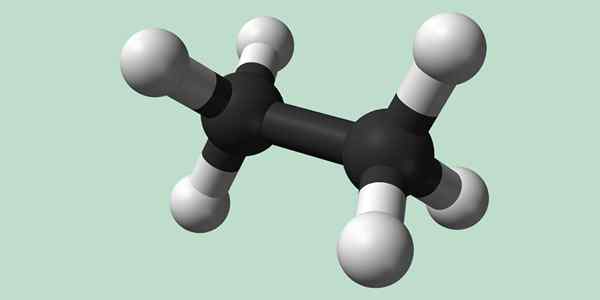
Chemická štruktúra etánu
Estano je molekula vzorca C2H6, zvyčajne považovaný za spojenie dvoch metylových skupín (-ch3) Na vytvorenie uhľovodíka jednoduchej väzby uhlíka-uhlík. Je to tiež najjednoduchšia organická zlúčenina po metáne, ktorá sa predstavuje:
H3C-C-CH3
Atómy uhlíka v tejto molekule majú hybridizáciu typu SP3, Takže molekulárne väzby majú voľnú rotáciu.
Existuje tiež vnútorný fenomén Etana, ktorý je založený na rotácii jeho molekulárnej štruktúry a minimálnej energie potrebnej na vytvorenie rotácie 360 -degrenovej prepojenia, ktorú vedci nazývajú „Etano Barrera“.
Z tohto dôvodu, Ethan.
 Chemická štruktúra etánu. Zdroj: Wikimedia Commons
Chemická štruktúra etánu. Zdroj: Wikimedia Commons Syntéza etánu
Estano sa dá ľahko syntetizovať z elektrolýzy Kolbe, organickej reakcie, v ktorej sa vyskytujú dva kroky: elektrochemická dekarboxylácia (odstránenie karboxylovej skupiny a oslobodenie oxidu uhličitého) dvoch karboxylových kyselín a kombinácia medziproduktov produktov za vzniku kovalentnej väzby.
Podobne, elektrolýza kyseliny octovej vedie k tvorbe etánu a oxidu uhličitého a táto reakcia sa používa na syntézu prvého.
Oxidácia anhydridu acetického anhydridu pôsobením peroxidov, koncept podobný elektrolýze Kolbe, tiež vedie k tvorbe etánu.
Môže vám slúžiť: Príspevky z chémie do ľudstvaRovnakým spôsobom sa dá účinne oddeliť od zemného plynu a metánu procesom skvapalnenia, pomocou kryogénnych systémov na zachytenie tohto plynu a oddelenie od zmesí s inými plynmi.
Proces expanzie turbo je obľúbený pre túto úlohu: Zmes plynu je vyrobená turbínou a vytvára jej expanziu, až kým jej teplota klesne pod -100 ° C.
Už v tomto bode sa dajú diferencovať zložky zmesi, takže kvapalný etán od plynného metánu a ostatné druhy zapojené do použitia destilácie budú oddelené.
Estano vlastnosti
Estano je v prírode prezentovaný ako toaletný a bezfarebný plyn na štandardné tlaky a teploty (1 atm a 25 ° C). Má bod varu -88,5 ° C a bod fúzie -182,8 ° C. Okrem toho nie je ovplyvnená vystavením silným kyselinám alebo základni.
Rozpustnosť etánu
Molekuly Etano sú symetrická konfigurácia a majú slabé príťažlivé sily, ktoré ich udržiavajú pohromade, nazývané disperzné sily.
Keď sa etán pokúša rozpustiť vo vode, sily príťažlivosti vytvorené medzi plynom a kvapalinou sú veľmi slabé, takže etán sa ťažko spojí s molekulami vody.
Z tohto dôvodu je rozpustnosť etánu značne nízka a mierne sa zvyšuje, keď stúpa tlak systému.
Kryštalizácia etánu
Estata sa môže upevniť a vytvára nestabilné etánové kryštály s kubickou kryštalickou štruktúrou.
S poklesom teploty nad -183,2 ° C sa táto štruktúra stáva monoklinickou, čím sa zvyšuje stabilita jej molekuly.
Spaľovanie etánu
Tento uhľovodík, aj keď sa nepoužíva ako palivo, sa dá použiť v spaľovacích procesoch na generovanie oxidu uhličitého, vody a tepla, ktorý je znázornený nasledovne:
2 c2H6 + 72 → 4Co2 + 6H2O + 3120 kJ
Existuje tiež možnosť spaľovať túto molekulu bez prebytočného kyslíka, ktorý je známy ako „neúplné spaľovanie“ a ktorý vedie k tvorbe amorfného oxidu uhoľnatého a oxidu uhoľnatého v nechcenej reakcii podľa množstva aplikovaného kyslíka:
Môže vám slúžiť: steroly: štruktúra, funkcie a príklady2 c2H6 + Tretí2 → 4C + 6H2Alebo + teplo
2 c2H6 + 42 → 2C + 2Co + 6H2Alebo + teplo
2 c2H6 + 52 → 4CO + 6H2Alebo + teplo
V tejto oblasti sa spaľovanie vyskytuje sériou reakcií voľných radikálov, ktoré sú očíslované v stovkách rôznych reakcií. Napríklad v neúplných spaľovacích reakciách sa môžu zlúčeniny, ako je formaldehyd, acetaldehyd, metán, metanol a etanol.
Bude to závisieť od podmienok, v ktorých sa vyskytujú reakcia a reakcie zapojených voľných radikálov. Etylén sa môže tiež tvoriť pri vysokých teplotách (600-900 ° C), čo je veľmi požadovaný produkt podľa priemyslu.
Estano v atmosfére a v nebeských telách
Estano je prítomný v atmosfére planéty Zeme v stopách a existuje podozrenie, že ľudskej bytosti sa podarilo zdvojnásobiť túto koncentráciu, odkedy začal praktizovať priemyselné činnosti.
Vedci si myslia, že veľká časť súčasnej prítomnosti ETA v atmosfére je spôsobená spaľovaním fosílnych palív, hoci svetová emisia etánu klesla takmer v polovici od doby, keď sa zlepšili technológie výroby plynu Lutita (zdroj zemného plynu).
Tento druh sa prirodzene vyskytuje vplyvom slnečných lúčov na atmosférický metán, ktorý rekombinuje a tvorí etánovú molekulu.
Na povrchu Titanu, jedným zo Saturnových mesiacov, je etán v kvapalnom stave. Toto je prezentované vo väčšom množstve na rieke Vid Flumina, ktorá tečie viac ako 400 kilometrov na jednom z jeho morí. Táto zlúčenina bola tiež preukázaná na kométach a na povrchu Pluto.
Použitie etánu
Etylén
Použitie etánu je založené hlavne na výrobe etylénu, ekologický produkt väčšieho využívania vo svetovej výrobe, prostredníctvom procesu známeho ako parný stupeň.
Tento proces spočíva v odovzdaní zriedeného Ethana.
Reakcia nastáva pri extrémne vysokej teplote (medzi 850 a 900 ° C), ale čas pobytu (čas, ktorý etán prechádza v rúre), musí byť stručná, aby bola reakcia účinná. Pri vyšších teplotách sa vytvára viac etylénu.
Môže vám slúžiť: Neón: História, vlastnosti, štruktúra, riziká, použitieZákladná chemická tvorba
Etano bol tiež študovaný ako hlavná zložka tvorby základných chemikálií. Oxidačná chlorácia je jedným z procesov zvýšených na získanie vinylchloridu (zložka PVC), čím nahradí ostatných menej ekonomických a komplikovanejších.
Chladivo
Nakoniec sa etán používa ako chladivo v bežných kryogénnych systémoch, ktoré tiež ukazujú kapacity zamrznutia malých vzoriek v laboratóriu na analýzu.
Je to veľmi dobrá náhrada za vodu, ktorá trvá viac na ochladenie jemných vzoriek a môže tiež vytvárať tvorbu škodlivých ľadových kryštálov.
Riziká etánu
-Estano má schopnosť zapáliť sa, hlavne keď sa pripojí k vzduchu. Percentuálny podiel 3,0 až 12,5% objemu etánu vo vzduchu je možné vytvoriť výbušná zmes.
-Môže obmedziť kyslík vo vzduchu, v ktorom sa nachádza, a preto predstavuje rizikový faktor udusenia pre ľudí a zvieratá, ktoré sú prítomné a vystavené.
-Etán v zmrazenej tekutej forme môže vážne spáliť pokožku, ak s ňou príde do priameho kontaktu, a tiež pôsobiť ako kryogénne médium pre akýkoľvek predmet, ktorý sa dotýka, a v okamihu ho zmrazí.
-Výpary tekutého etánu sú ťažšie ako vzduch a koncentrujú sa na zemi, čo môže predstavovať riziko vznietenia, ktoré môže vytvárať reťazovú spaľovaciu reakciu.
-Požitie Etano môže spôsobiť nevoľnosť, zvracanie a vnútorné krvácania. Vdýchnutie, okrem udusenia, spôsobuje bolesti hlavy, zmätok a zmenu humoru. Smrť v dôsledku zástavy srdca je možná na vysokých výstavách.
-Predstavuje skleníkový plyn, ktorý spolu s metánom a oxidom uhličitého prispieva k globálnemu zahrievaniu a zmene klímy generovaného znečistením človeka. Našťastie je menej hojné a trvajúce ako metán a absorbuje menej žiarenia ako toto.
Odkazy
- Britannica, e. (s.F.). Etán. Získané od Britannica.com
- Nes, G. Vložka. (s.F.). Jednokryštálové štruktúry a distribúcia hustoty elektrónov etánu, ethylénu a acetylénu. Koberec sa uzdravil.Nl
- Stránky, G. (s.F.). Etane: Zdroje a umývadlá. Získané z lokalít.Riadenie.com
- Softschool (s.F.). Etán. Zotavené z softschools.com
- Wikipedia (s.F.). Etán. Získané z in.Wikipedia.orgán

