Primárna štruktúra funkcií
- 4970
- 38
- Tomáš Mydlo
Ten primárna štruktúra proteínov Je to poradie, v ktorom sú usporiadané aminokyseliny polypeptidov. Proteín je biopolymér tvorený monomérmi a-aminokyselinami zjednotenými peptidovými väzbami. Každý proteín má definitívnu sekvenciu týchto aminokyselín.
Proteíny Vykonávajú obrovskú rozmanitosť biologických funkcií vrátane tvaru a udržiavania integrity buniek prostredníctvom cytoskeletu, bránia telo podivných látok protilátkami a katalyzujú chemické reakcie organizmu prostredníctvom enzýmov.
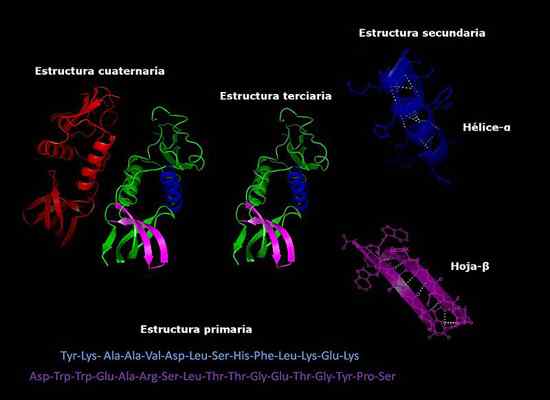
 Primárne, sekundárne, terciárne a kvartérne štruktúry proteínov, trojrozmerná konformácia. Prevzaté a upravené z: Alejandro Porto [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)].
Primárne, sekundárne, terciárne a kvartérne štruktúry proteínov, trojrozmerná konformácia. Prevzaté a upravené z: Alejandro Porto [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)]. V súčasnosti je stanovenie zloženia proteínov a poradia, v ktorom sú usporiadané aminokyseliny (sekvenovanie) rýchlejšie ako pred rokmi. Tieto informácie sú uložené v medzinárodných elektronických databázach, ku ktorým je možné pristupovať prostredníctvom internetu (Genbank, PIR, okrem iného).
[TOC]
Aminokyseliny
Aminokyseliny sú molekuly, ktoré obsahujú aminoskupinu a skupinu karboxylovej kyseliny. V prípade a-aminokyselín majú okrem atómu vodíka a výraznej skupiny R, ktorá sa nazýva bočná skupina, ktorá sa nazýva bočná skupina, ktorá sa nazýva bočná skupina, ktorá sa nazýva bočná skupina, ktorá sa nazýva bočná skupina, ktorá sa nazýva bočný reťaz.
Kvôli tejto konfigurácii a uhlíku sú aminokyseliny, ktoré sa tvoria, známe ako a-aminokyseliny, chirals. Existujú dve formy, ktoré sú navzájom zrkadlové obrazy a ktoré sa nazývajú enantioméry L a D.
Všetky proteíny živých bytostí sú tvorené 20 a-aminokyselinami konfigurácia L. Bočné reťazce týchto 20 aminokyselín sú rôzne a majú veľkú rozmanitosť chemických skupín.
V zásade je možné a-aminokyseliny zoskupovať (svojvoľne) v závislosti od typu bočného reťazca nasledujúcim spôsobom.
Alifatické aminokyseliny
V tejto skupine sú obsiahnuté podľa niektorých autorov, glycín (GLI), alanín (Wing), Valine (Val), Leucina (LEU) a izoleucín (ILE). Medzi ďalších autorov patrí aj metionín (MET) a prolín (Pro).
Môže vám slúžiť: fosfolipidy: charakteristiky, štruktúra, funkcie, typyAminokyseliny s bočnými reťazcami obsahujúcimi hydroxyl alebo síru
Obsahuje serín (SER), cysteín (CYS), Treonina (Thr) a tiež metionín. Podľa niektorých autorov by skupina mala zahŕňať iba Byt a Thr.
Cyklické aminokyseliny
Integrovaný iba prolínom, ktorý, ako už bolo zdôraznené, sú zahrnuté inými autormi medzi alifatickými aminokyselinami.
Aromatické aminokyseliny
Fenylalanín (PHE), tyrozín (Tyr) a Triphafano (TRP).
Základné aminokyseliny
Histidín (HIS), lyzín (Lys) a arginina (arg)
Kyslé aminokyseliny a jeho amidy
Obsahuje kyseliny aspartárovej (ASP) a glutam (GLU) a tiež aspargín (ASN) a glutamín (GLN). Niektorí autori rozdeľujú druhú skupinu na dve; Na jednej strane kyslé aminokyseliny (prvé dva) a na druhej strane, ktoré obsahujú karboxylamid (zostávajúce dva).
Peptidové spojenia
Aminokyseliny sa môžu navzájom spájať prostredníctvom peptidových väzieb. Tieto väzby, tiež nazývané väzby Amida, sa stanovujú medzi a-aminokyselinou jednej aminokyseliny a a-karboxylovou skupinou inej. Táto únia sa vytvára so stratou molekuly vody.
Spoja medzi dvoma aminokyselinami vedie k tvorbe dipéptidu a ak sa pridajú nové aminokyseliny, postupne, tripid, tetrapéptidy atď.
Polypeptidy tvorené malým počtom aminokyselín dostávajú všeobecný názov oligopeptidov a ak je počet aminokyselín vysoký, potom sa polypeptidy nazývajú polypeptidy.
Každá aminokyselina, ktorá sa pridá do polypeptidového reťazca, uvoľňuje molekulu vody. Časť aminokyseliny, ktorá stratila H+ alebo OH- počas únie, sa nazýva zvyšok aminokyseliny.
Väčšina z týchto oligopeptidových a polypeptidových reťazcov bude na jednom konci prezentovať skupinu amino-terminálnych (N-terminálnych) skupiny a v druhom koncovom karboxylovom (C-terminálnom). Okrem toho môžu obsahovať veľa ionizovateľných skupín medzi bočnými reťazcami odpadu z aminokyselín, ktoré ich tvoria. Z tohto dôvodu sa berú do úvahy polyanfolity.
Môže vám slúžiť: Flora a fauna z Campeche: Reprezentatívne druhy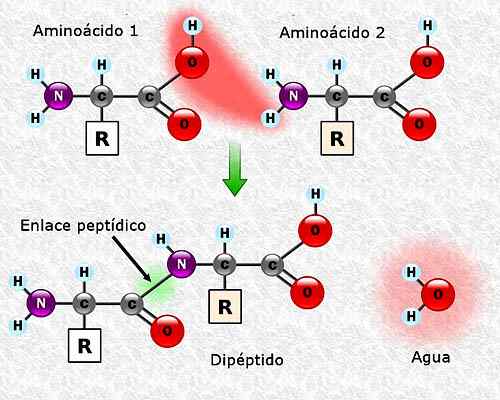 Tvorba peptidovej väzby medzi dvoma aminokyselinami. Prevzaté a upravené z: Alejandro Porto [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)].
Tvorba peptidovej väzby medzi dvoma aminokyselinami. Prevzaté a upravené z: Alejandro Porto [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)]. Aminokyselinová sekvencia
Každý proteín má určitú sekvenciu svojho odpadu z aminokyselín. Toto poradie je známe ako primárna štruktúra proteínu.
Každý jednotlivý proteín každého organizmu je špecifický pre tento druh. To znamená, že myoglobín ľudskej bytosti je identický s inou ľudskou bytosťou, ale má malé rozdiely s myoglobínmi iných cicavcov.
Množstvo a typy aminokyselín, ktoré proteín obsahuje, je rovnako dôležité ako umiestnenie týchto aminokyselín v polypeptidovom reťazci. Aby sa proteíny poznali, biochemici musia najprv izolovať a čistiť každý konkrétny proteín, potom vykonať analýzu obsahu aminokyselín a nakoniec určiť jeho sekvenciu.
Na izoláciu a čistenie proteínov existujú rôzne metódy, medzi ktorými patrí: odstredivka, chromatografia, gélová filtrácia, dialýza a ultrafiltrácia, ako aj použitie vlastností proteínovej rozpustnosti, ktoré sa majú študovať v štúdii.
Stanovenie aminokyselín prítomných v proteínoch sa vykonáva po troch krokoch. Prvým je prelomiť peptidové väzby hydrolýzou. Následne sa oddeľujú rôzne typy aminokyselín zo zmesi; A nakoniec, každý z typov získaných aminokyselín je kvantifikovaný.
Na stanovenie primárnej štruktúry proteínu je možné použiť rôzne metódy; Ale v súčasnosti najpoužívanejšou je Edmanova metóda, ktorá v podstate pozostáva z označovania a separácie N-terminálnej aminokyseliny od zvyšku reťazca opakovane a identifikácia každej aminokyseliny uvoľnenej individuálne.
Kódovanie proteínov
Primárna štruktúra proteínov je kódovaná v génoch organizmu. Genetické informácie sú obsiahnuté v DNA, ale na transláciu proteínu sa musí najskôr transkribovať na molekuly RNM. Každý nukleotidový triplet (kodón) kóduje aminokyselinu.
Môže vám slúžiť: Aké je chemické zloženie živých bytostí?Pretože existuje 64 možných kodónov a pri konštrukcii proteínov sa používa iba 20 aminokyselín, každá aminokyselina môže byť kódovaná viac ako jedným kodónom. Prakticky všetky živé bytosti používajú rovnaké kodóny na kódovanie rovnakých aminokyselín. Genetický kód sa preto považuje za takmer univerzálny jazyk.
V tomto kóde sú kodóny používané na spustenie a tiež zastavenie translácie polypeptidu. Kodóny dokončenia nekódujú žiadnu aminokyselinu, ale zastavia transláciu do reťazca C-terminálu a sú reprezentované Tripletmi UAA, UAG a UGA.
Na druhej strane, kodón AUG normálne funguje ako štartovací signál a tiež kóduje metionín.
Po translácii môžu proteíny utrpieť určité spracovanie alebo modifikáciu, ako je napríklad krátkodobo, na dosiahnutie svojej definitívnej konfigurácie.
Odkazy
- C.Klimatizovať. Mathews, K.A. Van Hold & K.G. Aber. 2002. Biochemery. 3th Vydanie. Benjamin / Cummings Publishing Company, Inc.
- Murray, P. Mayes, D.C. Granner & V.W. Rodwell. Devätnásť deväťdesiat šiestich. Harperov biochemer. Appleton & Lange
- J.M. Berg, J.L. Tymoczko & l. Stryer (SF). Biochemery. 5th Vydanie. W. H. Freeman a spoločnosť.
- J. Koolman & K.-H. Roehm (2005). Atlas z biochémie. 2Nd Vydanie. Tok.
- Do. Lehninger (1978). Biochémia. Omega Editions, s.Do.
- L. Stryer (1995). Biochemery. W.H. Freeman and Company, New York.
- « História čísla Avogadro, jednotky, ako sa vypočítava, používa
- Charakteristiky, štruktúra a funkcie exonukleázy »

