Kvartérna štruktúra charakteristických proteínov

- 4836
- 1287
- Tomáš Mydlo
Ten Kvartérna štruktúra proteínov Definuje priestorové vzťahy medzi každou zo svojich podjednotiek polypeptidov spojených s net -kovalentnými silami. V polymérnych proteínoch sa každý z polypeptidových reťazcov, ktoré ho tvoria, nazývajú podjednotky alebo protoméry.
Proteíny môžu byť tvorené jedným (monomérnymi), dvoma (Dimérica), niekoľkými (oligomérnymi) alebo mnohými protomérmi (polymérny) (polymérny). Tieto protoméry môžu mať medzi nimi podobnú alebo veľmi odlišnú molekulárnu štruktúru. V prvom prípade sa hovorí, že ide o homotypické proteíny a v druhom prípade heterotypické.
 Príklad kvartérnej štruktúry proteínu jadrového antigénu proliferačnej bunky. Prevzaté a upravené z: Thomas Shafee [CC po 4.0 (https: // creativeCommons.Org/licencie/o/4.0)].
Príklad kvartérnej štruktúry proteínu jadrového antigénu proliferačnej bunky. Prevzaté a upravené z: Thomas Shafee [CC po 4.0 (https: // creativeCommons.Org/licencie/o/4.0)]. Vo vedeckom zápise biochemici používajú grécke písmená s predplatnými na opis zloženia proteínových protomérov. Napríklad tetramerický homotypický proteín je označený ako a4, Zatiaľ čo tetramerický proteín tvorený dvoma rôznymi dimérmi je označený ako a2p2.
[TOC]
Proteín
Proteíny sú komplexné molekuly, ktoré získavajú rôzne trojrozmerné konfigurácie. Tieto konfigurácie sú exkluzívne pre každý proteín a umožňujú im vykonávať veľmi špecifické funkcie. Hladiny štrukturálnej organizácie proteínov sú nasledujúce.
Primárna štruktúra
Vzťahuje sa na sekvenciu, v ktorej sú usporiadané rôzne aminokyseliny v reťazci polypeptidu. Táto sekvencia je daná sekvenciou DNA, ktorá kóduje takýto proteín.
Sekundárna štruktúra
Väčšina proteínov nie sú dlhé reťazce úplne rozšírených aminokyselín, ale majú regióny, ktoré sa pravidelne skladajú vo forme vrtule alebo listov. Toto skladanie je také, ktoré sa nazýva sekundárna štruktúra.
Terciárna štruktúra
Zložené oblasti sekundárnej štruktúry sa môžu zase zložiť a zostaviť v kompaktnejších štruktúrach. Tento posledný záhyb je ten, ktorý dáva proteínu jeho trojrozmernú formu.
Kvartérna štruktúra
V proteínoch, ktoré tvoria viac ako jedna podjednotka, sú kvartérne štruktúry priestorové vzťahy, ktoré existujú medzi každou podjednotkou, ktoré sú spojené ne -kovalentnými väzbami.
Môže vám slúžiť: ako huby dýchajú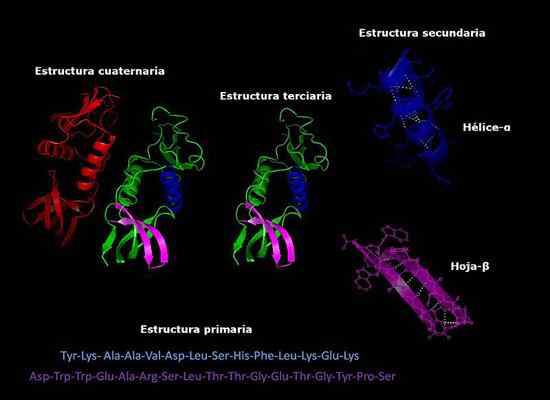 Primárne, sekundárne, terciárne a kvartérne štruktúry proteínov, trojrozmerná konformácia. Prevzaté a upravené z: Alejandro Porto [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)].
Primárne, sekundárne, terciárne a kvartérne štruktúry proteínov, trojrozmerná konformácia. Prevzaté a upravené z: Alejandro Porto [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)]. Stabilita kvartérnej štruktúry
Trojrozmerná štruktúra proteínov je stabilizovaná slabými alebo nekovalentnými interakciami. Aj keď sú tieto prepojenia alebo interakcie oveľa slabšie ako normálne kovalentné väzby, sú početné a ich kumulatívny účinok je silný. Ďalej uvidíme niektoré z najbežnejších interakcií.
Hydrofóbne interakcie
Niektoré aminokyseliny obsahujú hydrofóbne bočné reťazce. Keď proteíny majú tieto aminokyseliny, skladanie molekuly si tieto bočné reťazce rozkazujú do proteínu a chráni ich pred vodou. Povaha rôznych postranných reťazcov ich spôsobuje, že v hydrofóbnom účinku prispievajú rôznymi spôsobmi.
Van der Waals interakcie
Tieto interakcie sa vyskytujú, keď sa molekuly alebo atómy, ktoré nie sú zjednotené kovalentnými väzbami, príliš medzi nimi priblížia, a preto sa začnú prekrývať ich vonkajšie elektronické orbitály.
V tom čase sa medzi týmito atómami vytvorí odpudobná sila. Toto sú tak -called Van der Waals „sily“.
Interakcie zaťaženia
Je to elektrostatická interakcia, ktorá sa vyskytuje medzi niekoľkými zaťaženými časticami. V proteínoch sa vyskytuje tento typ interakcií, a to tak kvôli čistému elektrickému náboja proteínu, ako aj s individuálnym zaťažením iónov obsiahnutých vo vnútri. Tento typ interakcií sa niekedy nazýva Puente Salino.
Vodíkové väzby
Vodíkovou väzbou sa stanovuje medzi pripojeným atómom vodíka.
Tento typ väzby je veľmi dôležitý, pretože vlastnosti mnohých molekúl, vrátane vlastností vody a biologických molekúl, sú zväčša spôsobené vodíkovými väzbami. Vlastnosti zdieľania kovalentných dlhopisov (zdieľajú sa elektróny) a tiež nekovalentné interakcie (interakcia s nákladom).
Môže vám slúžiť: prechodné plodinyInterakcie DiPolos
V molekulách vrátane proteínov, ktoré nepredstavujú čisté zaťaženie, je možné predložiť nejednotné dispozície ich vnútorných zaťažení, s mierne záporným koncom ako iný. Toto je známe ako dipól.
Tento dipólový stav molekuly môže byť trvalý, ale môže sa tiež indukovať. DiPolos môžu byť priťahované iónmi alebo inými dipólami. Ak sú dipóly trvalé, interakcia má väčší rozsah, ako sa uvádza s indukovanými dipólami.
Okrem týchto nekovalentných interakcií niektoré oligomérne proteíny stabilizujú svoju kvartérnu štruktúru pomocou kovalentného typu spojenia, disulfidové spojenie. Tieto sú stanovené medzi sulfhydrillo skupinami cysteónov rôznych protomérov.
Disulfuro väzby tiež pomáhajú stabilizovať sekundárnu štruktúru proteínov, ale v tomto prípade sa cysteínový odpad spája vo vnútri toho istého polypeptidu (intrapopolipeptidové disulfidové väzby).
Interakcie medzi protomérmi
Ako už bolo uvedené, v proteínoch, ktoré sú zložené z niekoľkých podjednotiek alebo protomérov, môžu byť tieto podjednotky podobné (homotypické) alebo rôzne (heterotypické).
Homotypové interakcie
Podjednotky, ktoré tvoria proteín, sú asymetrické polypeptidové reťazce. Avšak pri homotypových interakciách môžu byť tieto podjednotky spojené rôznymi spôsobmi a dosahujú rôzne typy symetrie.
Skupiny, ktoré interagujú s každou protomérou, sa všeobecne nachádzajú v rôznych pozíciách, takže sa nazývajú heterológne interakcie. Heterológne interakcie medzi rôznymi podjednotkami, niekedy sa vyskytujú takým spôsobom, že každá podjednotka je krivovaná vzhľadom na precedens, špirálovú štruktúru a špirálovú štruktúru.
Pri iných príležitostiach sú interakcie dané takým spôsobom, že skupiny definovaných podjednotiek sú usporiadané okolo jednej alebo viacerých osí symetrie, čo je známe ako symetria bodových skupín. Ak existuje niekoľko osí symetrie, každá podjednotka rozbitá vzhľadom na jej 360 °/s susedom (kde n predstavuje počet osí).
Môže vám slúžiť: austrálska flóra a fauna: Reprezentatívne druhyMedzi typy symetrie, ktoré sa získavajú týmto spôsobom.
Keď dve podjednotky interagujú cez binárnu os, každá jednotka prerušená 180 ° vzhľadom na druhú, okolo tejto osi. Táto symetria je známa ako symetria C2. V ňom sú interakčné miesta v každej podjednotke identické; V tomto prípade sa nehovorí o interakcii heterológa, ale o izologickej interakcii.
Ak je naopak spojenie medzi dvoma zložkami diméru heterológ, potom sa získa asymetrický dimér.
Heterotypické interakcie
Nie vždy sú podjednotky, ktoré interagujú v proteíne. Existujú proteíny, ktoré tvoria dvanásť alebo viac rôznych podjednotiek.
Interakcie, ktoré udržiavajú stabilitu proteínu, sú rovnaké ako v homotypových interakciách, ale všeobecne sa získajú úplne asymetrické molekuly.
Napríklad hemoglobín je tester, ktorý predstavuje dva páry rôznych podjednotiek (a2p2).
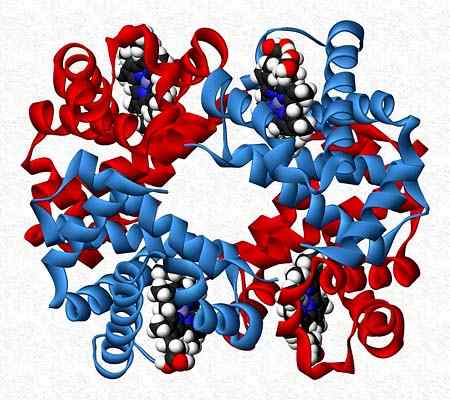 Kvartérna štruktúra hemoglobínu. Prevzaté a upravené z: Benjah-Bmm27. Upravené Alejandro Porto. [CC0].
Kvartérna štruktúra hemoglobínu. Prevzaté a upravené z: Benjah-Bmm27. Upravené Alejandro Porto. [CC0]. Odkazy
- C.Klimatizovať. Mathews, K.A. Van Hold & K.G. Ahern (2002). Biochemery. 3. vydanie. Benjamin / Cummings Publishing Company, Inc.
- R.Klimatizovať. Murray, P. Mayes, D.C. Granner & V.W. Rodwell (1996). Harperov biochemer. Appleton & Lange
- J.M. Berg, J.L. Tymoczko & l. Stryer (2002). Biochemery. 5. vydanie. W. H. Freeman a spoločnosť.
- J. Koolman & K.-H. Roehm (2005). Atlas z biochémie. 2. vydanie. Tok.
- Do. Lehninger (1978). Biochémia. Omega Editions, s.Do.
- L. Stryer (1995). Biochemery. W.H. Freeman and Company, New York.
- « 19. storočie v Čile populácii, spoločnosti, hospodárstve a politike
- Venimentínové charakteristiky, štruktúra, funkcie a použitia »

