Stavy agregácie hmoty
- 906
- 23
- Adrián Fajnor
Aké sú štáty agregácie hmoty?
Ten Stavy agregácie hmoty sú spôsoby, ako sa hmota prejavuje pred našimi očami a zmyslami. Priamo súvisia s stupňom interakcií ich prispôsobených častíc, buď atómov, iónov, molekúl, makromolekúl, buniek atď.
Keď hovoríme o stupni interakcie, odkazuje sa na to, ako silné sa častice spájajú medzi sebou a vytvorí súpravy, čo nakoniec konečne definuje fázu alebo stav materiálu. Máme teda tri základné stavy agregácie hmoty: tuhá látka, tekutina a plyn, všetky tu prítomné na Zemi do veľkých mierok.
Oceány a moria sú príkladmi tekutín. Atmosféra a vzduch, ktorý dýchame, zodpovedajú plynnému stavu. Medzitým sa ľadovci a zemská kôra predstavujú pevné látky na planéte Zem. Okrem týchto troch štátov môžete spomenúť koloidál, ktorý sa vyskytuje v oblakoch oblohy av symfínach prírodných predmetov.
Existujú aj ďalšie stavy agregácie hmoty, ktoré sa považujú za exotické, ktoré sa vyvíjajú iba v laboratóriách alebo na kozmických územiach za nepredstaviteľných podmienok teploty a tlakov. Niektoré z nich sú plazma, neutrónová hmota, fotonická hmota alebo kondenzát Bose-Einstein.
Stav agregácie
 Voda je príkladom tekutého stavu
Voda je príkladom tekutého stavu V tekutine sú interakcie medzi časticami silné, ale nie dosť na to, aby ich zbavovali voľného pohybu. Preto súpravy častíc definujú látku, ktorá je schopná zaberať celý objem kontajnera, ale zároveň prežíva silu príťažlivosti gravitácie.
V dôsledku toho má kvapalina povrch, ktorý pokrýva celú šírku nádoby. Toto je pozorované v akejkoľvek fľaši, vani, nádrži, studni, tégliku atď. Keď sa nádoba mieša, tekutina má tendenciu rozliať sa o okrajy alebo ju striekať priamo na zem.
Špeciálnou črtou tekutín je to, že môžu prúdiť podľa rozmerov kanála alebo potrubia.
Niektoré príklady tekutín sú nasledujúce:
-Vodná voda
-Olej
-Ropa
-Umyť
-Med
-Sirupy
-Bróm
-Ortuť
-Tetrachlorid
-Titánový tetrachlorid
-Roztavené soli
-Roztavené kovy
-Tekutý dusík
-Benzín
-Pivá
-Vína
-Ľadová kyselina octová
Existujú kvapaliny, ktoré tečú viac ako iné, čo znamená, že majú rôzne viskozity. Toto je vlastnosť tekutín, ktorá slúži na ich charakterizáciu; to znamená, že ich odlíšia jeden od druhého.
Môže vám slúžiť: FenantrenoStatus plynnej agregácie
Plyny sa vizualizujú ako bubliny v tekutinách alebo ako hmla alebo výpary. Interakcie medzi ich časticami sú slabé, čo medzi nimi spôsobuje veľkú vzdialenosť. V dôsledku toho tvoria látku, ktorá sotva pociťuje účinky gravitácie, a ktorá je rozmazaná v celom objeme nádoby, ktorý ju obsahuje.
V plynoch majú častice, či už majú atómy, ióny alebo molekuly, maximálnu voľnosť pohybu. V závislosti od ich hmotností môžu byť niektoré plyny hustejšie ako iné, čo priamo ovplyvňuje rýchlosť šírenia priestoru.
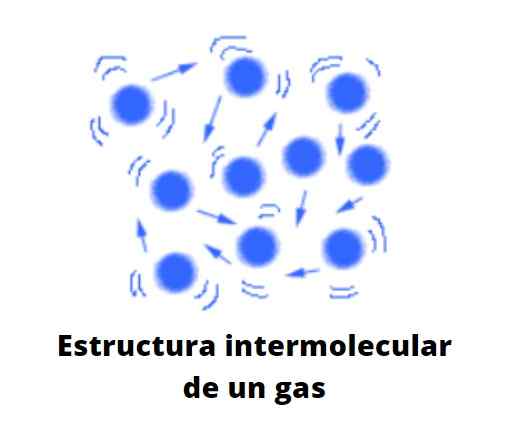
Tento stav agregácie hmoty sa považuje za nepolapiteľný, prchavý, bezkonkurenčný (nedotknuteľný) a rozptýlený.
Niektoré príklady plynov sú:
-Vodná para
-Oxid uhličitý
-Vysielať
-Plynulosť
-Amoniak
-Kyslík
-Vodík
-Hélium
-Chlór
-Fluór
-Metán
-Zemný plyn
-Etano
-Acetylén
-Fosfín
-Fosgén
-Siláno
-Oxidy dusíka (nieX)
-Oxid sír
-Ozón
-Hexafluoruro zo síry
-Dimetyléter
Plyny sú vo všeobecnosti nežiaduce, pretože v prípade únikov sa rýchlo rozširujú po celom priestore a tiež predstavujú vážne riziká ohňa alebo otravy. Plyny tiež vyvíjajú nebezpečné tlaky počas mnohých priemyselných procesov a sú kontaminantmi alebo odpadom, ktoré najviac ovplyvňujú atmosféru.
Stavu agregácie
 Minerály sú v tuhom stave
Minerály sú v tuhom stave Stav tuhej agregácie je charakterizovaný tým, že jeho častice majú silné interakcie. V dôsledku toho zažívajú všetku gravitačnú silu planéty, takže definujú svoje vlastné objemy bez ohľadu na to, čo sú kontajnery, a zanechávajú niekoľko dutých alebo prázdnych priestorov.
 Je pozorované, že tuhé častice majú silné interakcie, na rozdiel od plynu
Je pozorované, že tuhé častice majú silné interakcie, na rozdiel od plynu Pevné látky sa vyznačujú existujúcimi kryštalickými alebo amorfnými telami podľa stupňa objednávania ich častíc. Majú tiež ďalšie vlastnosti, ako je tvrdosť, nepreniknuteľnosť a hustota.
Niektoré príklady tuhých látok sú:
-Ľad
-Kosti
-Suchý ľad
-Uhlie
-Grafit
-diamant
-Minerály
-Choď von
-Skáka
-Drevo
-Mäso
-Zelenina
-Plasty
-Textilné vlákna
-Kovy
-Pevný tuk
-Zliatiny
-Pohár
-Jód
-Kovové komplexy
Pevné látky sú vo všeobecnosti najžiadanejšími látkami, pretože sú najjednoduchšie ukladať a manipulovať. Zodpovedajú tiež telám, s ktorými môžeme najviac interagovať s našimi zmyslami. Z tohto dôvodu vývoj nových materiálov takmer vždy vzbudzuje väčší záujem ako objav nových tekutín alebo plynov.
Môže vám slúžiť: kyselina maleico: Štruktúra, vlastnosti, získanie, použitieStatus koloidnej agregácie
 Hmla je príkladom toho, čo sa chápe ako stav koloidnej agregácie
Hmla je príkladom toho, čo sa chápe ako stav koloidnej agregácie Aj keď sa jeden zo základných stavov hmoty nepovažuje za tuhé, tekuté alebo plyn, pravdou je, že koloidný štát je v prírode a priemysle celkom bežný, čo pokrýva obrovský počet zmesí. Presne, koloidný stav sa nevyskytuje v čistých látkach, ale v zmesiach, kde je jedna z komponentov rozptýlená v hlavnej fáze.
Keďže sú zmesou, dve fázy predstavujú svoje vlastné agregácie. Napríklad dispergovaná fáza môže byť pevná, zatiaľ čo väčšina alebo dispergácia môže byť tiež pevná, sóda alebo kvapalina. Existuje niekoľko možností a kombinácií. Preto existuje veľa koloidných orgánov, ktoré sú v prírode.
Niektoré príklady koloidných látok sú:
-Oblaky
-Fajčiť
-Hmla a hmla
-Krv
-Zmrzliny
-Mlieko
-Majonéza
-Kečup
-Maslo
-Želé
-Arašidový krém
-Noviny
-Maľované sklo
-Farby
-Kozmetika
-Syr
-Porcelán
-Pena
-Maľba
Pozastavenia ako také sú však mimo štátov agregácie hmoty, pretože interakcie medzi ich zložkami nie sú také „intímne“, ako sa stáva pri koloidoch.
Sú to jednoducho zmesi, ktorých vlastnosti sa príliš nelíšia od toho, čo známe tekutiny alebo tuhé látky. Napríklad bahno, odpruženie, sa považuje za „vodu s veľkou pôdou“.
Štátny štát plazmy
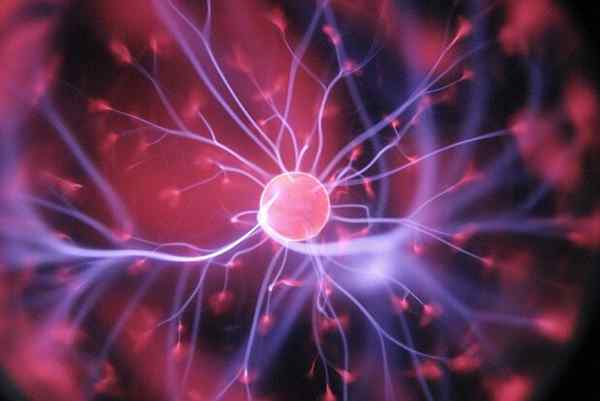 Plazmová lampa
Plazmová lampa V stave agregácie plazmy existuje krok k exotickej hmote. Už sa nehovorí o atómoch, molekulách alebo iónoch, ale o protónoch, neutrónov a elektrónov. Vychádza, keď plyn dostáva vysoké elektrické otrasy alebo sa vyskytuje obrovské teplo. Keď sa to stane, je to ionizované, to znamená, že stráca elektróny, aby získal pozitívne náboje.
Ako stratia elektróny, vytvárajú sa plynné ióny, až kým konečne sú jeho atómové jadrá nahé. Potom bude existovať „zlatá polievka“ protónov, neutrónov a elektrónov. V tejto polievke majú častice kolektívne správanie, čo znamená, že ich pohyby priamo ovplyvňujú pohyby ich susedov. Neukazujú také voľné správanie ako správanie plynov.
Plazmy sa vyznačujú jasnými a horúcimi látkami, ktoré integrujú hviezdne „tkanivo“. Preto sú v hviezdach a na našom slnku, pravdepodobne v stave najhojnejšej záležitosti vesmíru. Môžu však tiež vzniknúť tu na Zemi.
Môže vám slúžiť: kyselina ferulová: získanie, funkcie, aplikácieNiektoré príklady plazmy sú:
-Oheň
-Elektrické lúče
-Neónové svetlá
-Lasery
-Fluorescenčné žiarovky
-Slnečný vietor
-Hmlovina
-Plazmové televízory
-Komét
Stupeň plazmovej ionizácie, a preto sa jej energia môže líšiť, pričom použiteľné plazmy v aplikáciách a nástrojoch každodenného života.
Kondenzát Bose Einstein
Predpovedané vedcami Albert Einstein a Satyendra Nath Bose, kondenzát Bose-Einstein je stav, v ktorom sú bozóny, v tomto prípade atómy rubidia alebo sodíka, aglomerát v najnižšej energetickej podmienke pri veľmi nízkych teplotách, dotknuté absolútnou nulou.
Pri týchto teplotách sú atómy aglomerát alebo kondenzované takým spôsobom, že sa správajú, akoby boli jednou entitou: prebytok.
Stav agregácie neutrónov
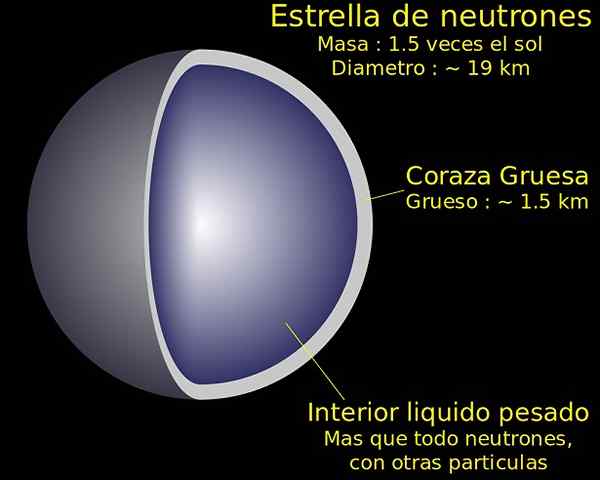
Neutrónová hmota je o pár krokov pred plazmou. Teraz sú podmienky, ktoré zažívajú častice, také intenzívne, že protóny a elektróny sa spájajú, aby vznikli neutrónmi. Preto bude existovať nepredstaviteľné množstvo vysoko zhutnených neutrónov.
Stav agregácie neutrónov sa nachádza v slávnych neutrónových hviezdoch, ktoré sú súčasťou najzaujímavejších nebeských a vyšetrovaných nebeských telies. Niektoré mince s pojmom „Neutronio“ na hmote zložené výlučne z neutrónov a boli zdrojom inšpirácie pre mnohé sci -fi diela.
Stav agregácie fotonickej agregácie
 Fotonická hmota je produktom podivnej interakcie fotónov svetla
Fotonická hmota je produktom podivnej interakcie fotónov svetla Doteraz sa hovorilo o interakciách, ktoré existujú medzi atómami, protónmi, neutrónmi, elektrónmi, molekulami atď., Tvoriť rôzne stavy agregácie hmoty. Ísť ešte ďalej, hraničná fantázia, sú možné interakcie medzi fotónmi svetla. Avšak nie žiadne svetlo, ale jedno z veľmi nízkej energie.
Na získanie fotónov s veľmi nízkou energiou, a tak vytvoríte „fotonické molekuly“ dvoch alebo troch fotónov, je potrebné z rubidium vyrobiť oblak zmrznutých atómov. Pri týchto teplotách a podmienkach vstúpia fotóny do oblaku ako jednotlivé entity a nechávajú ich v pároch alebo triosoch.
Predpokladá sa, že takéto interakcie môžu jedného dňa využiť informácie o ukladaní informácií v kvantových počítačoch, čím sú oveľa výkonnejšie a rýchlejšie.
Odkazy
- Whitten, Davis, Peck & Stanley. (2008). Chémia. (8. vydanie.). Učenie sa.
- Wikipedia. (2020). Stav hmoty. Zdroj: In.Wikipedia.orgán
- Chem.Purdue. (s.F.). Stavy hmoty. Získané z: Chem.Purdue.Edu
- Rader Andrew. (2018). Stavy hmoty. Obnovené z: chem4 kids.com
- María estela Raffino. (12. februára 2020). Stavy agregácie hmoty. Koncepcia.z. Získané z: koncepcie.z
- Chu Jennifer. (15. februára 2018). Fyzici vytvárajú novú formu svetla. MIT novinky. Obnovené z: noviniek.miznúť.Edu

