Hlylé charakteristiky štátu, všeobecné právo, príklady

- 2961
- 884
- Gabriel Bahna
On Plynný stav Je to stav agregácie subjektu, v ktorom sú častice udržiavané pohromade slabými interakciami a sú schopné pohybovať sa všetkými smermi nádoby, ktorá ich obsahuje. Zo všetkých fyzických stavov subjektu je plynný, ktorý prejavuje najväčšiu slobodu a chaos.
Plyny vyvíjajú tlak, prepravujú teplo a sú zložené z akéhokoľvek typu malých častíc. Naša atmosféra a vzduch, ktorý dýchame, sú prejavom plynného stavu tu na zemi.
 Pri dymových emanáciách je možné pozorovať správanie plynov skôr, ako sa rozptýlia atmosférou. Zdroj: pexels.
Pri dymových emanáciách je možné pozorovať správanie plynov skôr, ako sa rozptýlia atmosférou. Zdroj: pexels. Príkladmi plynu sú skleníkové plyny, ako je vodná para, oxid uhličitý, metán alebo ozón. Oxid uhličitý, ktorý vydýchneme v dýchaní, je ďalším príkladom plynnej látky.
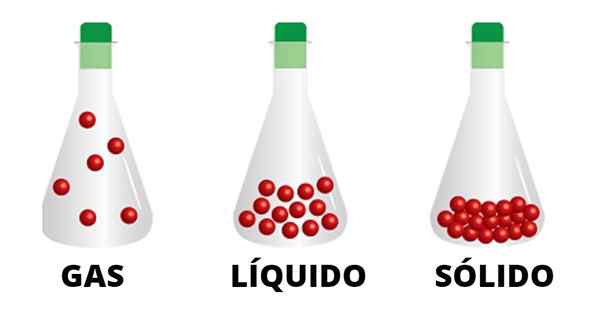 Plynné častice sú spojené slabými interakciami a pohybujú sa nádobou. Zistilo sa, že častice tekutého stavu sú zjednotnejšie a sú prísne spojené s tuhou farbou
Plynné častice sú spojené slabými interakciami a pohybujú sa nádobou. Zistilo sa, že častice tekutého stavu sú zjednotnejšie a sú prísne spojené s tuhou farbou Kvapaliny a tuhé látky sa napríklad nepresunú do pozícií nad rámec vlastných materiálových limitov, skutočnosť, ktorá sa nestane pri plynoch. Dym cigariet, komínov a veží, demonštrujte, ako plyn stúpá a rozptyľuje životným prostredím bez toho, aby ho čokoľvek zastavil.
[TOC]
Plynové charakteristiky stavu
Chýba mu objem alebo tvar
Plynný stav je charakterizovaný tým, že nemá definovanú formu alebo objem. Ak neexistujú žiadne hranice, ktoré by si ich udržali, bude sa rozptýliť v celej atmosfére. Aj ako v prípade héliu, bude uniknúť mimo Zeme.
Plyn môže získať iba tvar uložený nádobou. Ak je nádoba valcová, plyn „bude mať„ tvar valca “.
Môže vám slúžiť: kalorimetria: aké štúdie a aplikácieVodič
Tento stav sa tiež vyznačuje tým, že je zlým vodičom tepla aj elektriny. Všeobecne je to menej husté v porovnaní s pevnými a tekutými stavmi.
Pretože väčšina plynov je bezfarebná, napríklad kyslík a oxid uhličitý, je možné určiť, koľko z nich je v nádobe pomocou miery ich tlaku.
Činidlá
Plyny majú tendenciu byť reaktívnejšie, s výnimkou ušľachtilých plynov, ako kvapaliny alebo tuhé látky.
Malé častice
Plynné častice sú tiež zvyčajne malé, sú atómy alebo jednoduché molekuly.
Napríklad plynný vodík, h2, Je to veľmi malá molekula tvorená dvoma atómami vodíka. Máme tiež hélium, on, ktorého atómy sú ešte menšie.
Interakcie
Interakcie v plynnom stave sú opovrhnutiahodné. To sa výrazne líši od tekutých a tuhých stavov, v ktorých sú ich častice veľmi súdržné a navzájom silne interagujú. V molekulách, ktoré tvoria tekuté a tuhé stavy, je medzi nimi takmer žiadna molekulárna prázdnota.
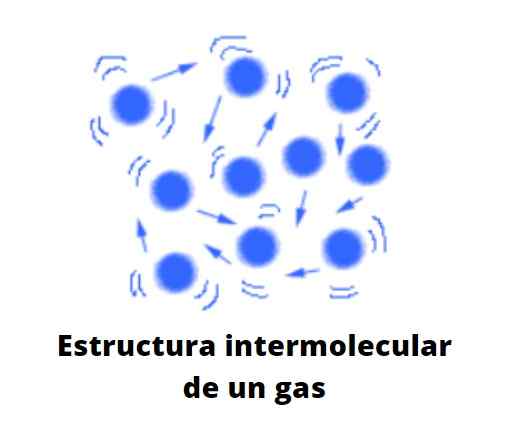
Častice v plynnom stave sú veľmi vzdialení jedným z ostatných, medzi nimi je veľa prázdnoty. Už to nie je vákuum v molekulárnej mierke. Vzdialenosť, ktorá ich oddeľuje, je natoľko, že každá častica v plyne je voľná, ľahostajná k svojmu okolia, pokiaľ v jej chaotickej trajektórii kolisrí s inou časticou alebo proti stene nádoby.
Môže vám slúžiť: zriedené riešenieAk sa predpokladá, že neexistuje žiadna nádoba, prázdnotu medzi časticami plynu môže byť obsadená vzduchom, ktorý tlačí a ťahá plyn smerom k smeru jeho prúdu. Preto vzduch, ktorý pozostáva z plynnej zmesi, je schopný deformovať a šíriť plynné látky, pokiaľ nie sú o oveľa hustejší ako on.
Všeobecné plynné štátne právo
Experimentálna štúdia správania a mechaniky plynov viedla k niekoľkým zákonom (Boyle, Charles, Gay-Lussac), ktoré sa kombinujú, aby predpovedali, aké parametre akéhokoľvek plynového systému alebo fenoménu budú, to znamená, čo bude jeho teplota, objem, objem, objem a tlak.
Tento všeobecný zákon má nasledujúci matematický výraz:
P = kt/v
Kde k je konštanta, p tlak a objem a T teplota plynu v Kelvinovej stupnici. Preto, keď poznáte dve premenné (povedzme, p a v), tretí je možné vyčistiť, čo by bolo neznáme (t).
Tento zákon umožňuje napríklad, čo by malo byť teplota plynu, uzamknutá v objeme V, aby sa zobrazil tlak P.
Ak k tomuto zákonu pridáme príspevok Amadeus Avogadro, potom budeme mať zákon o ideálnych plynách, ktorý zahŕňa aj počet častíc a spolu s nimi molárna koncentrácia plynu:
P = nrt/v
Kde n zodpovedá počtu mólov plynu. Rovnicu je možné prepísať ako:
P = crt
Kde c Je to molárna koncentrácia plynu (n/V). Zo všeobecného zákona sa teda získava ideálny zákon, ktorý opisuje, ako sa týka tlaku, koncentrácie, teploty a objemu ideálneho plynu.
Môže vám slúžiť: Preosejte saPríklady plynného stavu
Plynné prvky
Rovnaká periodická tabuľka ponúka dobrý repertoár príkladov prvkov, ktoré sú prezentované na Zemi ako plyny. Medzi nimi máme:
-Vodík

-Hélium
-Dusík
-Kyslík
-Fluór
-Chlór
-Neón
-Argón
-Kripton
-Xenón
To neznamená, že iné prvky sa nemôžu stať plynným. Napríklad kovy sa môžu transformovať na plyny, ak sú vystavené vyšším teplotám ako ich príslušné body varu. Môžu teda existovať plyny železa, ortuti, striebro, zlata, meď, obvody, iridium, častice Osmio; akéhokoľvek kovu.
Plynné zlúčeniny
V nasledujúcom zozname máme niekoľko príkladov plynných zlúčenín:
-Oxid uhoľnatý, CO
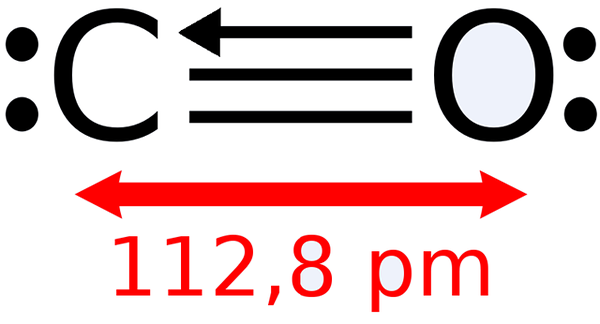 Lewisova štruktúra oxidu uhoľnatého
Lewisova štruktúra oxidu uhoľnatého -Oxid uhličitý, CO2 (plyn, ktorý tvorí naše výdychy)
-Amoniak, NH3 (Vital Lett pre priemyselné procesy symfíny)
-Oxid sulfur, tak3
-Metán, ch4 (domáci plyn, s ktorým sa varí)
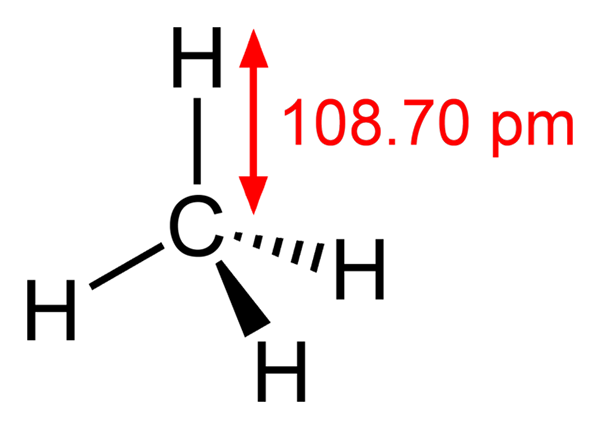 Metán
Metán -Etano, ch3Chvály3
-Oxid dusíka, nie2 (hnedý sfarbenie plyn)
-Phosgen, Cocl2 (Vysoko jedovatá látka)
-Vzduch (je zmesou dusíka, kyslíka, argónu a iných plynov)
-Vodná para, h2Alebo (ktorý je súčasťou oblakov, geiserov, odparovacích zariadení atď.).
-Acetylén, hc≡ch
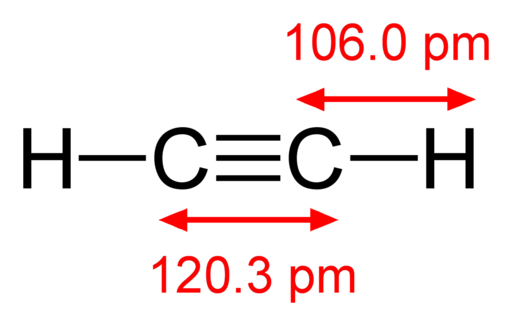 Štrukturálny vzorec acetylénu
Štrukturálny vzorec acetylénu -Jódové pary, i2 (Fialová farebná plyn)
-Hexafluoruro zo Síry, SF6 (veľmi hustý a ťažký plyn)
-Hydrazín, n2H4
-Chlorid vodíka, HCl (ktorý rozpustený vo vode produkuje kyselinu chlorovodíkovú)
Odkazy
- Whitten, Davis, Peck & Stanley. (2008). Chémia. (8. vydanie.). Učenie sa.
- Wikipedia. (2020). Plyn. Zdroj: In.Wikipedia.orgán
- Edward a. Murár. (6. februára 2020). Plyn. Encyclopædia Britannica. Získané z: Britannica.com
- HelMestine, Anne Marie, PH.D. (11. februára 2020). Definícia plynu a príklad v chémii. Zotavené z: Thoughtco.com
- María estela Raffino. (12. februára 2020). Aký je plynný stav? Získané z: koncepcie.z

