Vlastnosti mikroskopickej mierky, počítanie častíc, príklady
- 3187
- 563
- Alan Milota
Ten Mikroskopická stupnica Je to ten, ktorý sa používa na meranie veľkostí a dĺžok, ktoré nie je možné vidieť voľným okom a ktoré sú pod dĺžkou milimetra. Od vyšších po najnižšie sú mikroskopické stupnice v metrickom systéme:
- Milimeter (1 mm), ktorý je desatinou centimeter alebo tisíciny jedného merača. V tomto je mierka, v ktorej máme jednu z najväčších buniek v tele, čo je vajíčka, ktorej veľkosť je 1,5 mm.
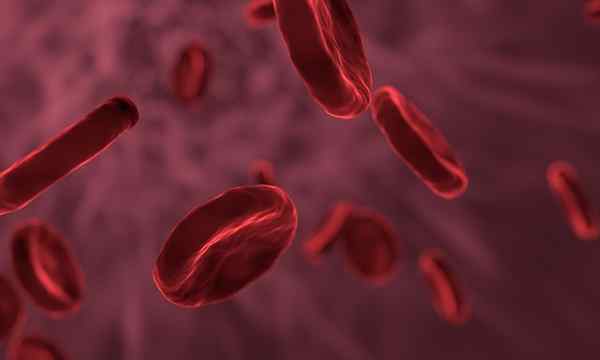
 postava 1. Červené krvinky sú bunky mikroskopických mierok. Zdroj: Pixabay
postava 1. Červené krvinky sú bunky mikroskopických mierok. Zdroj: Pixabay - Desatina milimetra (0,1 mm). Toto je mierka hrúbky alebo priemeru ľudských vlasov.
- Mikrometer alebo micra (1 μm = 0,001 mm). V tomto meradle sú rastlinné a živočíšne bunky a baktérie.
Rastlinné bunky sú rádovo 100 μm. Živočíšne bunky sú desaťkrát menšie, sú rádovo 10 μm; Zatiaľ čo baktérie sú 10 -krát nižšie ako živočíšne bunky a sú rádovo 1 μm.
[TOC]
Nanometrická stupnica
Existujú dokonca aj menšie opatrenia ako mikroskopická stupnica, ale ktoré sa zvyčajne nepoužívajú, s výnimkou niektorých špeciálnych kontextov. Ďalej uvidíme niektoré z najdôležitejších nanometrických opatrení:
- Nanometer (1 ηm = 0,001 μm = 0,000001 mm) je miliónty milimetra. V tomto rozsahu sú niektoré vírusy a molekuly. Vírusy sú rádovo 10ηm a molekuly rádovo 1ηm.
- Angstrom (1å = 0,1ηm = 0,0001 μm = 10-7mm). Toto opatrenie tvorí atómovú stupnicu alebo veľkosť.
- Fantometer (1FM = 0,00001å = 0,000001ηm = 10-12mm). Toto je rozsah atómových jadier, ktoré sú medzi 10 tisíc a 100 000 -krát menší ako atóm. Napriek svojej malej veľkosti sa však jadro koncentruje 99,99% atómovej hmoty.
- Atómové jadro sú menšie stupnice. Ale je ich viac: tieto častice sú zase tvorené základnými časticami, ako sú kvarky.
Nástroje pre mikroskopické pozorovanie
Ak sú objekty medzi milimetermi a mikrometrickou stupnicou (1 mm - 0,001 mm), môžu sa pozorovať pomocou optického mikroskopu.
Ak sú však objekty alebo štruktúry medzi nanometrami a Angstrom, budú sa vyžadovať elektronické alebo nanoskopické mikroskopy.
V elektronickej mikroskopii sa používajú elektróny s vysokou energetikou s vysokou energiou, ktoré majú oveľa nižšiu vlnovú dĺžku ako svetlo. Nevýhodou elektronického mikroskopu je to, že nie je možné.
Môže vám slúžiť: magnetický šok: jednotky, vzorce, výpočet, príkladyNa druhej strane sa laserové svetlo používa v nanoskope a má výhodu oproti elektronickej mikroskopii, že štruktúry a molekuly sa dajú vyzerať a zaznamenať vo vnútri živých buniek.
Nanotechnológia je technológia, s ktorou sa obvody, štruktúry, časti a dokonca aj motory vyrábajú na stupniciach od nanometrov po atómovú stupnicu.
Mikroskopické vlastnosti
Vo fyzike sa pri prvom prístupe správanie hmoty a systémov študuje z makroskopického hľadiska. Z tejto paradigmy je záležitosť nekonečne deliteľné kontinuum; A tento pohľad je platný a primeraný pre mnoho situácií každodenného života.
Niektoré javy makroskopického sveta však majú vysvetlenie iba vtedy, ak sa zohľadňujú mikroskopické vlastnosti veci.
Podľa mikroskopického hľadiska sa berie do úvahy molekulárna a atómová štruktúra záležitosti. Na rozdiel od makroskopického prístupu v tomto rozsahu existuje granulárna štruktúra s otvormi a priestormi medzi molekulami, atómami a dokonca aj v nich.
Ďalšou charakteristikou mikroskopického hľadiska vo fyzike je to, že kus hmoty bez ohľadu na to, ako malá, sa skladá z obrovského počtu častíc oddelených od seba a v nepretržitom pohybe.
-Hmota je obrovská prázdnota
V malom koláči.
To znamená, že kus hmoty na mikroskopickom meradle je obrovská medzera s koncentráciami atómov a jadier, ktoré zaberajú veľmi malú časť celkového celkového objemu. V tomto zmysle má mikroskopická stupnica podobnosť s astronomickou mierkou.
Makroskopických objektov k objavu atómu
Prvé chemikálie, ktoré boli alchymisti, si uvedomili, že materiály môžu byť dvoch typov: čisté alebo zlúčeniny. To dosiahlo myšlienku chemických prvkov.
Môže vám slúžiť: tlakový gradient: Čo je to a ako sa vypočítaBoli objavené prvé chemické prvky, boli sedem kovov staroveku: striebro, zlato, železo, olovo, cín, meď a ortuť. Postupom času boli objavené viac v rozsahu, v akom sa zistili látky, ktoré sa nedajú rozložiť v iných.
Potom boli prvky klasifikované podľa ich vlastností a charakteristík v kovoch a nemetáloch. Všetci, ktorí mali podobné chemické vlastnosti a afinita.
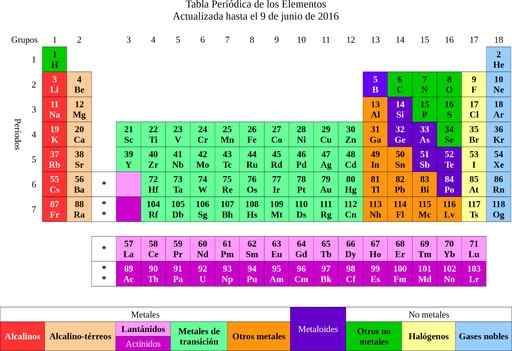 Obrázok 2. pravidelná tabuľka prvkov. Zdroj: Wikimedia Commons.
Obrázok 2. pravidelná tabuľka prvkov. Zdroj: Wikimedia Commons. Z prvkov, ktoré išlo k myšlienke atómov, slovom, ktoré znamená nedeliteľné. Krátko neskôr si vedci všimli, že atómy mali štruktúru. Okrem toho mali atómy dva typy elektrického náboja (kladné a záporné).
Subatomické častice
V Rutherfordových experimentoch, v ktorých bombardoval atómy tenkého zlata s alfa časticami, bola odhalená štruktúra atómu: malé pozitívne jadro obklopené elektrónmi.
Pokračovali v bombardovaní atómov stále viac energetických častíc a stále sa robia, aby sa v menšom meradle čoraz viac rozpadli tajomstvá a vlastnosti mikroskopického sveta.
Týmto spôsobom bol dosiahnutý štandardný model, ktorý ukazuje, že skutočné elementárne častice sú tie, z ktorých sú atómy zložené. Atómy zase vedú k prvkom, tieto zlúčeniny a všetky známe interakcie (okrem gravitácie). Celkovo je tu 12 častíc.
Tieto základné častice majú tiež pravidelnú tabuľku. Existujú dve skupiny: fermionické častice rotácie ½ a Bosonic. Bosonic je zodpovedný za interakcie. Fermionika je 12 a sú tí, ktorí vedú k protónom, neutrónom a atómom.
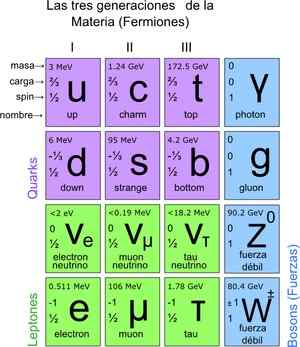 Obrázok 3. Základné častice. Zdroj: Wikimedia Commons.
Obrázok 3. Základné častice. Zdroj: Wikimedia Commons. Ako spočítať častice na mikroskopickej stupnici?
V priebehu času objavili chemici relatívne hmotnosti prvkov z presných meraní v chemických reakciách. Napríklad by sa dalo zistiť, že uhlík je 12 -krát ťažší ako vodík.
Zistilo sa tiež, že vodík je najľahší prvok, takže tomuto prvku bola priradená relatívna hmotnosť 1.
Na druhej strane, chemikálie potrebné na poznanie počtu častíc zapojených do reakcie, takže ani žiadne činidlo chýba. Napríklad molekula vody vyžaduje dva atómy vodíka a jeden kyslík.
Môže vám slúžiť: zvlnené javyZ týchto pozadí sa koncept mol rodí. Jeden mol akejkoľvek látky je pevné množstvo častíc ekvivalentných jej molekulárnej alebo atómovej hmotnosti v gramoch. Zistilo sa teda, že 12 gramov uhlíka má rovnaký počet častíc ako 1 gram vodíka. Toto číslo je známe ako Avogadro číslo: 6,02 x 10^23 častíc.
-Príklad 1
Vypočítajte, koľko atómov zlata je v 1 grame zlata.
Riešenie
Je známe, že zlato má atómovú hmotnosť 197. Tieto údaje možno nájsť v periodickej tabuľke a naznačujú, že atóm zlata je 197 -krát ťažší ako jeden z vodíka a 197/12 = 16 416 -krát ťažší ako uhlík.
Zlatý mol má 6,02 × 10^23 atómov a má atómovú hmotnosť vyjadrenú v gramoch, to znamená 197 gramov.
V grame zlata je 1/197 mólov zlata, čo je 6,02 × 10^23Atomos/197 = 3,06 x10^23 Gold Atómy.
-Príklad 2
Stanovte počet molekúl uhličitanu vápenatého (Caco3), že existuje 150 gramov tejto látky. Povedzte tiež, koľko atómov vápnika, koľko uhlíka a koľko kyslíka je v tejto zlúčenine.
Riešenie
Prvá vec je určiť molekulárnu hmotnosť uhličitanu vápenatého. Periodická tabuľka naznačuje, že vápnik má molekulovú hmotnosť 40 g/mol, uhlík 12 g/mol a kyslík 16 g/mol.
Potom molekulová hmotnosť (Caco3) byť:
40 g/mol + 12 g/mol + 3 x 16 g/mol = 100 g/mol
Každých 100 gramov uhličitanu vápenatého je 1 mol. Potom v 150 gramoch zodpovedá 1,5 molu.
Každý mol uhličitanu má molekuly uhličitanu 6,02 x 10^23.
Zhrnutie, v 150 gramoch uhličitanu vápenatého je:
- 9,03 x 10^23 Molekuly uhličitanu vápenatého.
- Atómy vápnika: 9,03 x 10^23 .
- Tiež 9,03 x 10^23 atómy uhlíka
- Nakoniec 3 x 9,03 x 10^23 atómy kyslíka = 27,09 x 10^23 atómov kyslíka.
Odkazy
- Aplikovaná biológia. Aké sú mikroskopické opatrenia?. Obnovené z: YouTube.com
- Chemické vzdelávanie. Makroskopické, submikroskopické a symbolické reprezentácie na hmote. Získané z: SCIELO.orgán.mx.
- Garcia a. Kurz interaktívnej fyziky. Makro -state, mikrostaty. Teplota. Zdroj: SC.Ehu.je
- Mikroskopická štruktúra hmoty. Získané z: alipso.com
- Wikipedia. Mikroskopická úroveň. Získané z: Wikipedia.com

