Pedári
- 2813
- 2
- Mgr. Pravoslav Mokroš
 postava 1. Pedári. Zdroj: Wikimedia Commons.
postava 1. Pedári. Zdroj: Wikimedia Commons. Aká je pulzovacia stupnica?
Ten Pedári Je to ľubovoľný rozsah, ktorý sa používa v chémii na vyjadrenie Elektronegativita prvky. Toto je definované ako tendencia určitého atómu prilákať elektróny, keď je kombinovaná s iným atómom.
V tomto zmysle majú prvky s vysokou elektrónou tendenciu ľahko získať elektróny. Toto sú ne -metal, zatiaľ čo z ich strany, čím menej elektronegatívnych prvkov, ako sú kovy, je pre nich ľahšie poskytnúť elektróny.
Preto poznanie elektronickejpativity prvku má predstavu o type spojenia, ktorý je schopný formovať sa v kombinácii s iným. Uvidíme to s číselným príkladom neskôr.
S týmito informáciami môžete predpovedať mnoho vlastností, ktoré bude mať zlúčenina, niečo veľmi užitočné v experimentálnej chémii a pre vedu o materiáloch, kde sa neustále vytvárajú nové zlúčeniny.
Je však vhodné objasniť, že napriek tomu, aký dôležitý je, neexistuje jedinečný spôsob určenia elektronegativity; Paulingova stupnica je iba jednou z rôznych foriem navrhnutých na jeho nájdenie, hoci je to jedna z najpoužívanejších.
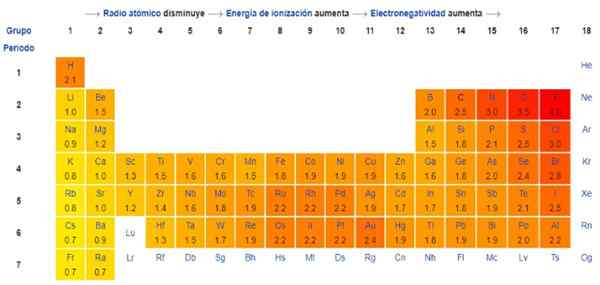
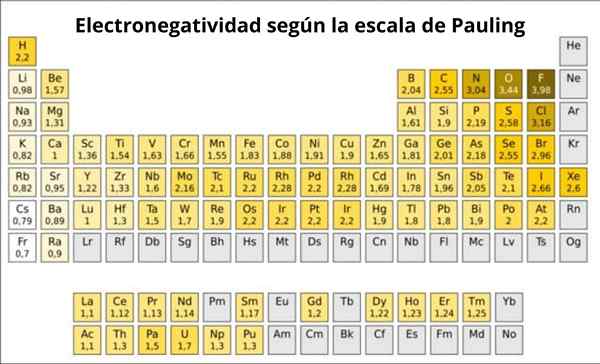
Pauling's je v skutočnosti svojvoľná stupnica, v ktorej je k každému prvku periodickej tabuľky priradená číselná hodnota, ktorá odráža jeho elektronegativitu. Vidíme to na obrázku 1, kde máte elektronegativitu každého prvku, ako to pridelil dvojnásobná Nobelova cena Linus Pauling (1901-1994) okolo roku 1939.
Elektronegativita prvkov
Pauling, vedľa Don M. Yost, zistil empiricky hodnoty elektronegativity prostredníctvom experimentálnych údajov, ktoré sa získali meraním energie spojenia.
Pauling pridelený k fluóru.0. Takže, keď sa formuje fluorid, vykazuje najvyšší trend prilákať elektróny medzi všetkými prvkami.
Môže vám slúžiť: koordinačné číslo: čo je, výpočet, príkladyDruhým je kyslík, s 3.5 a tretí je dusík s 3.0. Obidve sú umiestnené nad a napravo od stola.
Na druhej strane, na opačnom konci, najmenej elektronegatívnym prvkom je cézium, ktorého symbolom je CS, ktorý sa nachádza vľavo od tabuľky, ktorý Pauling priradil číslo 0.7.
Elektronegativita v periodickej tabuľke
Všeobecne a ako je uvedené na obrázku 1, elektronegativita - a ionizačná energia - sa zvyšuje zľava doprava v periodickej tabuľke. Všeobecný trend tiež naznačuje pokles pri pohybe zhora nadol.
Preto ich najviac elektronegatívne prvky budú mať v pravom hornom uhle stola: fluór, kyslík, chlór, dusík. Najmenej elektronegatívne -alebo najkrajšie elektropozitívne, ak sú preferované -bude vľavo: lítium, sodík, draslík a ďalšie prvky skupiny 1 -stĺp extrémnej ľavej strany, zodpovedajúce alkalickým a zásaditým kovom-.
V každom stĺpci sa elektronegativita znižuje zvýšením atómového prvku, s výnimkou prechodných kovov v strede, ktoré tento trend nedodržiavajú.
Dôležitým bodom na zdôraznenie je, že elektronegativita je relatívna, nie je nemennou vlastnosťou každého prvku a meria sa iba vzhľadom na vlastnosť iných prvkov. Závisí to veľa od oxidačného stavu, takže ten istý prvok môže vykazovať odlišnú elektronegativitu, v závislosti od typu zlúčeniny, ktorá sa tvorí.
Prepojenie energetického rozdielu
 Obrázok 2. Americký chemik Linus Pauling v roku 1955. Zdroj: Wikimedia Commons.
Obrázok 2. Americký chemik Linus Pauling v roku 1955. Zdroj: Wikimedia Commons. V chémii je spojenie spôsob, akým sú atómy spojené, rovnaké alebo odlišné, za vzniku molekúl. Medzi atómami sú sily, ktoré ich udržiavajú pohromade stabilné.
Existuje niekoľko typov odkazov, ale tu sa uvažujú dva:
- Kovalentný, v ktorých atómy podobných elektronegativitov zdieľajú niekoľko elektrónov.
- Iónový, Časté medzi atómami s rôznymi elektronegativitami, v ktorých prevláda elektrostatická príťažlivosť.
Predpokladajme, že dva prvky A E B môžu navzájom tvoriť molekuly, označené AA a BB. A sú tiež schopní spojiť sa a vytvoriť zlúčeninu AB, všetko prostredníctvom nejakého typu odkazu.
Vďaka účasti intermolekulárnych síl je v odkaze energia. Napríklad energia v AA Link je eAa, V BB Link je odliv a nakoniec v zložení AB je eAB.
Ak bude molekula AB vytvorená kovalentnou väzbou, teoreticky je spojená energia priemerom energie aAa a eBb:
AAB = ½ (eAa + ABb)
Pauling vypočítaný eAB Pre niekoľko zlúčenín to zmerala experimentálne a určila rozdiel medzi dvoma hodnotami, ktoré nazýva δ:
Δ = | (eAB) merané - (eAB) Teoretické | = | (EAB) merané - ½ (eAa + ABb) |
Pauling uvažoval takto: ak je δ veľmi blízko 0, znamená to, že elektronegativita oboch prvkov je podobná a spojenie, ktoré ich spája, je kovalentný. Ale ak δ nie je malý, potom spojenie medzi A a B nie je čisté kovalentné.
Čím väčšia je absolútna hodnota δ, tým väčší je rozdiel medzi elektrónou prvkov A a B, a preto spojenie, že UNE bude iónového typu. Neskôr čitateľ nájde príklad, v ktorom je možné vypočítať Δ, je možné určiť typ spojenia zlúčeniny.
Rovnice pre elektronegativitu
Od skutočnosti, že rozdiel v energii je signál, ktorý odlišuje povahu spojenia, Pauling urobil veľa experimentov, ktoré ho viedli k vytvoreniu empirického výrazu pre relatívnu elektronegativitu dvoch prvkov, ktoré tvoria molekulu.
Označením takej elektronegativity ako χ (grécke písmeno „Chi“) Pauling definoval δ takto:
F2· Δ = [χ (a) - χ (b)]2
χ (a) - χ (b) = f√5 = 0.102√5
Môže vám slúžiť: Tanteo Balance: Kroky, príklady a cvičeniaVšimnite si, že δ je kladné množstvo. FATIA F = 0.102, ktoré sa javí vynásobením druhej druhej koreňa δ, je konverzný faktor medzi KJ (kilojoules) a EV (elektrón-volt), obidve jednotky energie.
Ak sa namiesto toho použijú kilokalorórie a elektrónové volty, rozdiel v elektronickej farbe je vyjadrený s podobným vzorcom, ale s f = 0.208:
χ (a) - χ (b) = 0.208 steny
Pauling začal priraďovať vodík hodnotu 2.1, predchádzajúca hodnota, ktorú získal chemik Robert Mulliken. Tento prvok si vybral ako východiskový bod, pretože tvorí kovalentné prepojenia s mnohými ďalšími.
Prostredníctvom predchádzajúcej rovnice pokračoval v prideľovaní hodnôt súvisiacich so zvyškom prvkov. Uvedomila si, že elektronegativita sa zvyšuje, keď sa pohybuje zľava doprava a zhora nadol v periodickej tabuľke, ako je opísané v predchádzajúcej časti.
Príklad
Nižšie je uvedený zoznam prvkov: N, J a M a ich príslušné elektronegativity χ podľa Pauling Scale:
-N: Χ = 4.0
-J: Χ = 1.5
-A: Χ = 0.9
-M: Χ = 1.6
Medzi nasledujúce zlúčeniny vytvorené s nimi:
Yj, yn, mn a jm
Poukazujte na ten, ktorý má najväčší iónový charakter a na ktorého povahu je kovalentná. Dôvod svojej odpovede.
Riešenie
Podľa kritérií stanovených Paulingom bude zlúčenina s najvyšším iónovým charakterom s najväčším rozdielom medzi elektronickými orgánmi, a preto je väčšia hodnota δ. Zlúčenina s najnižším rozdielom v energii je tá, ktorá má kovalentnú väzbu.
Potom vypočítame, koľko δ má hodnotu pre každú zlúčeninu nasledovne:
Zložená yj
Δ = [χ (y) - χ (j)]2 = (0.9 - 1.5)2 = 0.36
Yn zlúčenina
Δ = [χ (y) - χ (n)]]]]]]]]]]2 = (0.9 - 4.0)2 = 9.61
Zložená MN
Δ = [x (m) - χ (n)]2 = (1.6 - 4.0)2 = 5.76
Zlúčenina
Δ = [χ (j) - χ (m)]2 = (1.5 - 1.6)2 = 0.01
Z vyššie uvedených výsledkov vyplýva, že zlúčenina iónového charakteru je yn, ktorej δ = 9.61, zatiaľ čo zlúčenina kovalentného charakteru je jm, s δ = 0.01.

