Vysvetlenie chemickej rovnováhy, faktory, typy, príklady

- 715
- 153
- Denis Škriniar
On chemická rovnováha Je to stav, ktorý dosahuje reverzibilné chemické reakcie, v ktorých sa nevyrábajú žiadne zmeny koncentrácií alebo činidiel, ani príslušných výrobkov. Vyznačuje sa tým, že je dynamický a nie statický; to znamená, že molekuly alebo atómy naďalej reagujú, ale udržiavajú rovnaké koncentrácie v priebehu času.
Podobná rovnováha je uvedená aj vo fázových zmenách, hoci nedochádza k žiadnym zlomovým zlomom. Napríklad kvapalina môže byť v rovnováhe so svojimi výparmi, ako aj ako pevná látka. Podobne tuhá látka vytvára rovnováhu s vodami, ktoré ju obklopujú, keď sa vyzráža alebo kryštalizuje.
 V chemickom priemysle je znalosť chemickej rovnováhy nevyhnutná na získanie syntézy s lepšími výnosmi. Zdroj: pxhere.
V chemickom priemysle je znalosť chemickej rovnováhy nevyhnutná na získanie syntézy s lepšími výnosmi. Zdroj: pxhere. Po vytvorení chemickej rovnováhy nie je možné získať viac zmien alebo odpovedí, pokiaľ nie je prerušená alebo ovplyvnená vonkajšími činmi. Je to teda pri syntéze produktu modifikované niekoľko parametrov, ako je tlak, objem alebo teplota, takže maximálne množstvo produktu sa generuje v rovnováhe.
V opačnom prípade bude množstvo výrobkov neuspokojivé; to znamená, že dôjde k zlej reakčnej výkonnosti. Preto je chemická rovnováha životne dôležitá pre chemický priemysel a všeobecne pre akúkoľvek syntézu bez ohľadu na jej rozsah.
V chemickej rovnováhe môže byť viac výrobkov alebo viac činidiel. Všetko záleží na tom, kde je vyrovnaný rovnováha. Berúc do úvahy niekoľko faktorov, môžete v reverzibilnej reakcii posunúť rovnováhu smerom k ktoréhokoľvek z dvoch smerov dvojitého šípky.
[TOC]
Vysvetlenie chemickej rovnováhy
Pred vyvážením
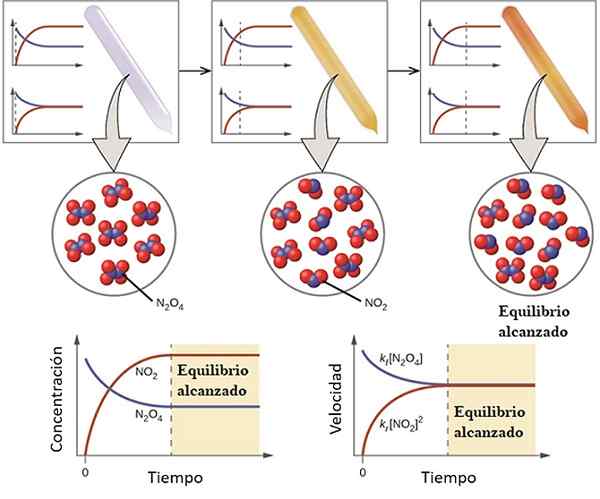 Príklad toho, ako sa reakcia blíži k jej rovnováhe. Zdroj: Openstax/CC od (https: // creativeCommons.Org/licencie/o/4.0)
Príklad toho, ako sa reakcia blíži k jej rovnováhe. Zdroj: Openstax/CC od (https: // creativeCommons.Org/licencie/o/4.0) Aby sme pochopili, čo je chemická rovnováha považovaná za nasledujúcu reverzibilnú reakciu:
N2Ani4g) ⇌ Nie2g)
Plyn n2Ani4 Je bezfarebný, zatiaľ čo plyn nie2 predstavuje hnedé alebo hnedé sfarbenie. Ak sa špecifické množstvo n vstrekuje do malej injekčnej liekovky alebo nádoby2Ani4, Bude to bezfarebné, kým sa vyváži rovnováha.
Naľavo od horného obrázka je zrejmé, že takmer všetky molekuly sú n2Ani4 a že koncentrácia NO2 Je nula.
Zobraziť tiež dva grafy, ktoré predstavujú, aký je trend v rovnováhe, pričom bodkovaná čiara smeruje polohu v čase, keď sa vstrekuje iba n2Ani4. Graf zodpovedá koncentrácii vs. Čas (dole ruky) a druhý zodpovedá grafu pri rýchlosti vs. Čas (dole pravá ruka).
Koncentrácia n2Ani4, [N2Ani4] (modrá čiara) sa postupne znižuje, pretože jej časť sa disociuje na výrobu molekúl č2. Preto je koncentrácia NO2, [Nie2] (červená čiara) rovná nule na začiatku, čoskoro sa zvýši, keď n2Ani4 Disociovať.
Je to však reverzibilná reakcia: časť molekúl No Molecules2 Sa pripoja k vytvoreniu n2Ani4. Preto budú dve reakcie, priame a inverzné, každá s vlastnými rýchlosťami.
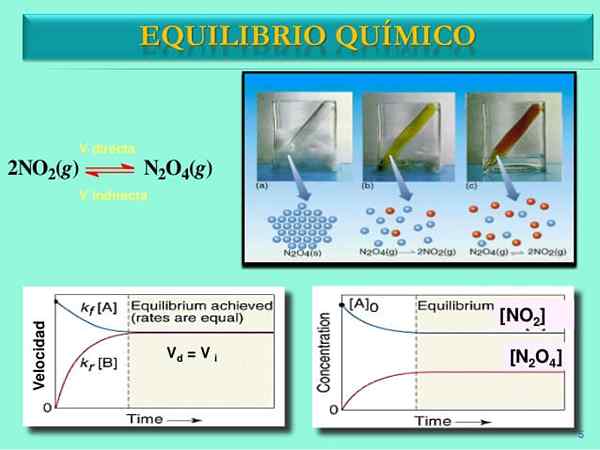 Zdroj: Slideshare.slepo
Zdroj: Slideshare.slepo Rýchlosť reakcie
Spočiatku rýchlosť spotreby n2Ani4 je väčšia ako rýchlosť spotreby NO2. Je zrejmé, že mať iba n2Ani4, Niekoľko molekúl vytvorených z NO2 Sotva môžu ocitnúť, aby reagovali. V tomto bode sa injekčná liekovka začne tlmiť oranžovou farbou, pretože existuje zmes n2Ani4 a nie2.
Postupne, pretože existuje viac molekúl č2 Na ceste a že n molekuly2Ani4 Disociujú sa, rýchlosti týchto dvoch reakcií sa budú zhodovať, aj keď sa koncentrácie navzájom líšia. To znamená, nie2] má tendenciu byť väčší ako [n2Ani4], preto je červená čiara nad modradou čiarou.
Môže vám slúžiť: fyzikálno -chemické vlastnostiVšimnite si, že rýchlosť sa stáva DC/DT, to znamená zmena koncentrácie vzhľadom na čas. Preto dva C vs. t a Vložka vs. t nie sú identické.
Pri rovnováhe
Raz pár n2Ani4-Nie2 Nastavte rovnováhu, rýchlosti oboch reakcií sa zhodujú a získajú sa nasledujúce matematické výrazy:
Vložkapriamy = k1[N2Ani4]
Vložkaobrátiť sa = k-1[Nie2]2
Vložkapriamy = Vložkaobrátiť sa
klimatizovať1[N2Ani4] = k-1[Nie2]2
klimatizovať1/k-1 = [Nie2]2/ [N2Ani4]
Klimatizovaťrovnica = [Nie2]2/ [N2Ani4]
V tomto okamihu bude cesta zafarbená ešte viac ako hnedá, pretože rovnováha je viac vysídlená smerom k vytvoreniu [nie2]. To znamená, krovnica, Rovnovážna konštanta musí byť väčšia ako 1, berúc do úvahy vyšší vzťah, [nie2]2/ [N2Ani4].
V koncentráciách rovnováhy [n2Ani4] a nie2] Zostávajú konštantné, pričom obe reakcie sa dejú rovnakou rýchlosťou: určité množstvo n je iba disociované2Ani4, Rovnaké množstvo sa vytvorí okamžite z dôvodu reakcie určitého množstva NO2.
Z tohto dôvodu sa hovorí, že chemická rovnováha je dynamická: molekuly n2Ani4 a nie2 Stále sa zúčastňujú na reakciách, aj keď nedochádza k zmene ich koncentrácií.
A byť rovnakými reakčnými rýchlosťami pre oba zmysly, červená a modrú čiara v grafike Vložka vs. T Hraj na horizontálnej čiare.
Rovnovážna konštanta
Rovnovážna konštanta pre predchádzajúcu reakciu bude vždy rovnaká, pri určitej teplote, bez ohľadu na to, koľko n2Ani4 sa vstrekuje na začiatku do cesty. Bude to tak, aj keď sa priamo vstrekuje zmes n2Ani4 a nie2, potom v pokoji, kým sa rovnováha nedosiahne.
Keď sa dosiahne rovnováha a merajú sa koncentrácie [n2Ani4] a nie2], vzťah [nie2]2/ [N2Ani4] dá to isté Krovnica Za túto reakciu. Čím väčšie je (keq >> 1), tým viac produktov bude v rovnováhe. A menšie (keq << 1), más reactivos habrá en el equilibrio.
Koncentrácie [n2Ani4] a nie2] Nebudú vždy. Napríklad, ak sa do injekčnej liekovky vstrekujú malé objemy, alebo ak naopak, vstrekujú sa torrenty týchto plynov do reaktora, množstvá sa budú značne meniť. K všakrovnica Zostane rovnaká, pokiaľ je teplota rovnaká v oboch procesoch.
Klimatizovaťrovnica Je náchylný na zmeny teploty: pri vyššej teplote bude väčšia hodnota. To znamená pri vyššej teplote v rovnováhe, že bude mať tendenciu tvoriť viac produktov. Je to tak, pokiaľ reakcia nie je exotermická, ako bude vysvetlené v nasledujúcej časti.
Faktory, ktoré ovplyvňujú chemickú rovnováhu
Faktory, ktoré ovplyvňujú chemickú rovnováhu v reverzibilnej reakcii, sú: koncentrácia, tlak a teplota.
- Koncentrácia
V reverzibilnej reakcii, podľa princípu Le Chatliera, zvýšením koncentrácie činidla dôjde k posunu chemickej rovnováhy doprava, aby sa zvýšila koncentrácia reakčných produktov.
Naopak, ak sa k reakcii pridá produkt, chemická rovnováha sa presunie doľava, aby sa zvýšila koncentrácia činidiel. Ak sa ako príklad použije nasledujúca reakcia:
C (s) +o2g) ⇌ 2 Co (g)
Zvýšením koncentrácie reagencií (C a O2), Rovnováha sa posunie doprava, to znamená smerom k tvorbe produktu oxidu uhoľnatého (CO) (CO). Ale zvýšenie koncentrácie CA bude spôsobiť vytesnenie rovnováhy vľavo, aby sa zvýšila koncentrácia C a O2.
Môže vám slúžiť: Carbonyl Group: Charakteristiky, vlastnosti, nomenklatúra, reaktivita- Tlak
Pri reakcii vyvinutej v plynnej fáze, zmeny objemu alebo tlaku vyvíjaného na plynne do nej, spôsobí zmenu rovnováhy v závislosti od počtu mólov reagencií a produktov.
Ak zložky reakcie reakcie (reagenty a produkty) majú rozdiely v počte mólov zapojených do reakcie, napríklad dimerizácia oxidu dusičného (nie2):
2 Nie2g) ⇌2Ani4g)
Zvýšenie tlaku vyvíjaného na reakciu v plynnej fáze, čo je dôsledok zníženia alebo nie objemu reakcie, spôsobí vytesnenie chemickej rovnováhy na stranu, ktorá má menej plynových krémov. V tomto príklade: produkt n2Ani4.
Naopak, zníženie tlaku spôsobí vytesnenie rovnováhy na stranu reakcie, ktorá má najväčší počet krmov. V danom príklade sa posunie smerom k reagenciám (nie2), Aby pôsobil proti zníženiu tlaku.
Ak sa v reakcii sódy fázy móly reagencií rovnajú mólom produktov, zmeny v tlaku neovplyvnia chemickú rovnováhu.
- Teplota
Endotermická reakcia
Pri endotermickej reakcii sa teplo môže považovať za činidlo, pretože jeho prívod je potrebný na to, aby sa reakcia vyskytla:
A +Q ⇌ B
Q = dodávané teplo
Preto pri endotermickej reakcii, keď sa teplota zvyšuje, sa rovnováha presunie doprava. Medzitým, keď sa teplota zníži, rovnováha sa presunie doľava.
Teplo je súčasťou reagencií, aby sa konzumovalo na transformáciu na b.
Exotermická reakcia
Pri exotermickej reakcii sa vytvára teplo, čo je produktom reakcie:
A ⇌ B +Q
Pri exotermickej reakcii, keď sa teplota zvýši, sa rovnováha presunie doľava (činidlá), pretože sa zvyšuje produkcia tepla. Medzitým, keď sa teplota zníži, rovnováha sa presunie doprava (výrobky).
Teplo je súčasťou výrobkov, keď sa teplota zvýši, nebude potrebné prispievať viac tepla do životného prostredia. A preto sa rovnováha bude snažiť využiť výhody ďalšieho tepla na výrobu viac reagencií; V tomto prípade viac ako.
Chemická rovnováha
V závislosti od fyzikálneho stavu reakčných zložiek môže byť chemická rovnováha homogénna alebo heterogénna.
Homogénna rovnováha
V tomto type rovnováhy, všetko Reagencie a výrobky majú rovnaký fázový alebo tekutý stav. Napríklad:
N2g) +3 h2g) ⇌ 2 nh3g)
Tu je také2, ako h2 a NH3 Sú to plynné látky.
Heterogénna rovnováha
Existuje, keď nie všetko Reagencie a výrobky majú rovnakú fázu alebo fyzickú podmienku. Napríklad:
2 NAHCO3(s) ⇌ na2Co3(s) +co2g) +h2O (g)
Tu máme NAHCO3 a na2Co3 ako pevné látky a CO2 a h2Alebo ako plyny alebo výpary.
Príklady chemickej rovnováhy
Disociácia kyseliny octovej vo vode
Kyselina octová, Cho3COOH, disociuje sa vo vode, ktorá vytvára rovnováhu:
Chvály3COOH (AC) + H2Alebo (l) ⇌ cho3Coo-(Ac) + h3Ani+(Ac)
Reakcia, ktorej rovnovážna konštanta sa nazýva konštantná kyslosť.
Izomerizáciaanin bután
Plyn n-Butano sa dá izomerizovať podľa nasledujúcej reverzibilnej reakcie na produkciu izoméru izoméru:
Chvály3Chvály2Chvály2Chvály3g) ⇌ cho3Chváli3)2g)
Tvorba oxidu dusnatého v atmosfére
V atmosfére sa môže tvoriť oxid dusnatého, aj keď veľmi sotva, z dusíka a kyslíka vzduchu:
N2g) + alebo2g) ⇌ 2No (g)
Môže vám slúžiť: Čo je to prostredie? (Príklady výpočtu)Krovnica Z tejto reakcie je 2,10-31 pri 25 ° C, takže sa vytvorí opovrhnuteľné množstvo NO.
ReakciaaniN kompodukcie striebra s AmonomJoAc
Strieborné ióny, ag+, Môžu byť dokončené amoniakom podľa nasledujúcej reverzibilnej reakcie:
Zápis+(Slnko) + 2nh3(L) ⇌ [ag (nh3)2]+(slnko)
Vyriešené cvičenia
Cvičenie 1
Aký typ chemickej rovnováhy zodpovedá nasledujúcej reakcii?
2Nocl (g) ⇌ 2No (g) + cl2g)
Táto reakcia zodpovedá homogénnej rovnováhe, pretože všetky príslušné látky, NOCL, NO a CL2, Sú to plyny.
Cvičenie 2
Pri rovnakej reakcii zhora, akú zmenu rovnováhy by sa dalo očakávať, ak sa tlak náhle zvýši?
Počítajme móly reagencií:
2Nocl
Máme 2 móly NOCL. Teraz povedzme mólom výrobkov:
2NO + CL2
Máme tri móly: dva z NO a jeden z CL2. Na strane výrobkov je viac plynných mólov. Zvýšenie tlaku preto spôsobí, že sa rovnováha posunie na ľavú stranu smerom k tvorbe NOCL. Týmto spôsobom sa systém snaží zmierniť účinky tlaku, ktorý uprednostňuje tvorbu NOCL a nie z NO a CL2.
Cvičenie 3
Pri rovnakej reakcii zhora predpokladajme, že sa náhle vstrekuje značný objem Cl2. Čo sa stane vyvážením?
Pri pridávaní CL2 do reaktora alebo nádoby sa jeho koncentrácia zvyšuje ako produkt reakcie. A preto sa rovnováha posunie späť doľava, aby sa vytvorila viac NOCL.
Cvičenie 4
Ak disociácia NOCL pri 227 ° C má 4 rovnovážnu konštantu 4.5 · 10-4, Aký smer je vyvážená vyvážená?
Opäť, byť Krovnica Menej ako 1 (4.5 · 10-4 < 1), en el equilibrio se espera que haya más NOCl que NO o Cl2, pretože je premiestnený doľava.
Cvičenie 5
Podľa nasledujúcej reakcie v rovnováhe:
[CO (Oh2)6]2+(Ac) +4cl-(Ac) +q ⇌ [cocl4]2-(Ac) +6h2Alebo (l)
A s vedomím, že komplex [CO (OH2)6]2+ Je ružová a že komplex je [COCL4]2- Je to modro, aké zmeny by ste očakávali, že uvidíte, či zohrievate nádobu pomocou [CO (OH2)6]2+? Čo by ste očakávali, či po zahrievaní nádoby by som ju umiestnil do kúpeľne s ľadom?
Reakcia je endotermická, pretože absorbuje teplo, ktoré ako činidlo. Preto pri zahrievaní nádoby s [CO (OH2)6]2+, Rovnováha sa posunie doprava smerom k vytvoreniu [COCL4]2-. Zmena modro ružového sfarbenia bude.
Potom, ak je modrú farbná nádoba s [COCL4]2- Je umiestnený v kúpeľni s ľadom, reakcia sa teraz presunie doľava smerom k tvorbe CO (OH2)6]2+:
[COCL4]2-(Ac) +6h2Alebo (l) ⇌ [co (OH2)6]2+(Ac) +4cl-(Ac) +q
Je to preto, že spätná reakcia je exotermická a má teplo, ktoré je produktom. Preto pri ochladení nádoby s [COCL4]2- Modrá, komplex [co (oh (oh (oh (Oh2)6]2+, A ružová farba sa znova objaví.
Odkazy
- Whitten, Davis, Peck & Stanley. (2008). Chémia. (8. vydanie.). Učenie sa.
- Emedikálna príprava. (s.F.). Typy rovnováhy. Získané z: Emedicprep.com
- Lúmen bezhraničná chémia. (s.F.). Faktory, ktoré využívajú chemickú rovnováhu. Uzdravené z: kurzov.Lumenarning.com
- Wikipedia. (2020). Chemická rovnováha. Zdroj: In.Wikipedia.orgán
- Chémia librettexts. (24. mája 2020). Výpočty rovnováhy - Sub ilustratívne skúšky. Získané z: Chem.Librettexts.orgán
- Meyers Amy. (2020). Rovnováha: chemická a dynamická. Štúdium. Získané z: štúdie.com
- HelMestine, Anne Marie, PH.D. (11. februára 2020). Chemická rovnováha v chemických reakciách. Zotavené z: Thoughtco.com

