Entalpía
- 2245
- 201
- Alfréd Blaho
Čo je entalpia?
Ten entalpía Je to termodynamická vlastnosť, ktorej variácie, za konštantných podmienok teploty a tlaku, určuje kalórií látky alebo systému spojenú s chemickou reakciou alebo fyzikálnym procesom. Ako štátna funkcia je zastúpená listom v kapitáli H, je jeho variácia.
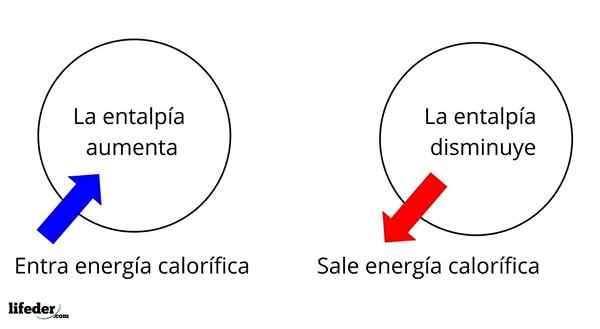
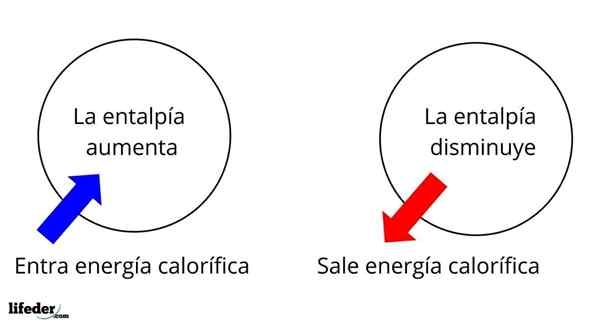
Je to jedna z najzákladnejších rozsiahlych vlastností na štúdium termochémie mnohých reakcií; To znamená, že hovoríme o odlúčení alebo absorpcii tepla medzi médiom reakcie a jeho okolím. Hovoríme teda, že reakcia je exotermická, ak je jeho AH negatívna (AH 0).
 Zmena entalpie v topení ľadu je pozitívna, čo naznačuje, že ľad absorbuje teplo z prostredia, aby sa presunul do tekutého stavu, vode
Zmena entalpie v topení ľadu je pozitívna, čo naznačuje, že ľad absorbuje teplo z prostredia, aby sa presunul do tekutého stavu, vode Napríklad ľad má entalpiu, hľad, Zatiaľ čo voda má tiež svoju vlastnú entalpiu, hvodná voda. Keď sa ľad topí, nastane variácia entalpie, ktorá sa nazýva ΔHFus alebo topiace sa teplo (hvodná voda-Hľad). Vodná entalpia je lepšia ako ľad, čo spôsobuje AHFus Lebo ľad je pozitívny a má hodnotu +6.01 kJ/mol.
Entalpia a jej variácie sú zvyčajne vyjadrené v jednotkách joule alebo kalórií. Zmena entalpie +6.01 kJ/mol označuje, že ľadový mol musí absorbovať 6.01 KJ kalorickej energie alebo tepla na topenie.
Ako sa počíta entalpia?
Entalpia a jej variácie
Samotná entalpia je nevyčísliteľná, pretože záleží na premenných, ktoré je ťažké presne zmerať. Dobrým porovnaním by bolo chcieť zmerať celkový objem oceánov: vždy ich budú existovať pod zemou alebo rozptýlené medzi kontinentmi. Preto av praxi nie je možné určiť H; Ale áno ΔH.
Môže ti slúžiť: koloidNa dosiahnutie matematického výrazu, ktorý umožňuje výpočet AH, musí sa najprv ponechať zo základnej definície entalpie:
H = u + pv
Byť vnútornou energiou systému alebo predmetnej látky a PV tlakovo-objemu práce, ktorú tento systém vyvíja na okolie, aby existoval. Keď máme záujem o výpočet ΔH a nie H, máme:
ΔH = AU + A (PV)
Ak je tlak konštantný, rovnica zostane:
ΔH = ΔU + PAV
Na druhej strane vieme, že:
ΔU = Otázka + W
Bytosť Otázka Úplne a w. Nahradenie nás:
ΔH = Otázka + W + PAV
Ale navyše vieme, že:
W = - pAV
A preto:
ΔH = Otázka - PAV + PAV
ΔH = Otázka
To znamená, že AH pre reakciu alebo proces, uskutočňovaný pri konštantnom tlaku, sa bude rovnať tepla Otázka generované alebo absorbované.
Reakcie Zmeny entalpie
Predpovede, že tlak zostáva konštantný, je možný, ak dôjde k reakcii pod zemskou atmosférou. Napríklad ľad zimných krajín sa topí bez toho, aby zažil ďalší tlak ako v našej atmosfére. Na druhej strane sa vzťahuje aj na reakcie v tekutých médiách alebo na tie, ktoré neprodukujú veľké množstvo plynov.
Tieto reakcie absorbujú alebo uvoľňujú teplo Otázka rovná AH, čo je zase rozdielom v entalpiách medzi produktmi a reaktantmi:
ΔH = HProdukty - HReaktant
Typy entalpie
Je bežnou praxou hovoriť o AH a H, akoby boli rovnaké: obaja sa nazývajú entalpies. Avšak, pokiaľ ide o typy, H je jedinečný pre každú látku alebo systém; Zatiaľ čo AH, na druhej strane, podlieha povahe reakcie alebo procesu samy o sebe.
V tomto zmysle máme najprv pozitívne variácie entalpie (AH> 0) alebo negatívne (AH <0); unas corresponden a los procesos o reacciones endotérmicos (se enfrían los alrededores), mientras las segundas tienen que ver con los procesos o reacciones exotérmicos (se calientan los alrededores).
Môže vám slúžiť: nitrobenzén (C6H5N2): Štruktúra, vlastnosti, použitia, rizikáZnak „+“ alebo '-', ktorý sprevádza ΔH, nám preto hovorí, či došlo k oslobodeniu alebo absorpcii tepla v určitej reakcii alebo procese; ktoré majú svoje vlastnosti AH, ako súčasť ich termochemických vlastností.
Máme nekonečné typy entalpií, ktoré možno klasifikovať podľa fyzikálnych procesov alebo chemických reakcií.
Fyzikálne procesy
Fázová zmena entalpie
Látky musia absorbovať alebo uvoľňovať teplo, aby sa presunulo z materiálu alebo materiálovej fázy (pevná látka, kvapalina alebo plyn) na inú. Napríklad ľad absorbuje teplo na topenie, takže entalpia pre túto fázovú zmenu zodpovedá fúzii, AHFus, tiež nazývané latentné teplo tepla.
Entalpia rozpustenia alebo zmesi
Látky, keď sú rozpustené alebo zmiešané v rozpúšťadlovom médiu, môžu absorbovať alebo uvoľňovať teplo, a tak mať entalpiu AHDisk alebo ΔHZmiešať.
Chemické reakcie
Výcvik
Je to pridružené teplo, ΔHºF, k tvorbe zlúčeniny, konkrétne jedného mólu, z jej zložkových prvkov v štandardných podmienkach tlaku a teploty (t = 298.15 k a p = 1 bankomat).
Entalpia
Je to pridružené teplo, ΔHdus, k degradácii zlúčeniny v menších a jednoduchých látkach. Je to všeobecne pozitívne, pretože na prelomenie väzieb molekúl je potrebné teplo.
Entalpia
Je to pridružené teplo, ΔHh, K závislosti na molekule vodíka na zlúčeninu, zvyčajne uhľovodík.
Entalpia spaľovania
Je to uvoľnené teplo, ΔHhrebeň, Keď látka horí reagujúce s kyslíkom. Je to negatívne, pretože sa uvoľňujú teplo a svetlo (oheň).
Môže vám slúžiť: atómová hmotnosť: definícia, typy, ako ho vypočítať, príkladyPríklady entalpií
Nakoniec sa uvádza zmienka o niektorých konkrétnych príkladoch entalpií:
Spaľovanie metánu
Chvály4 + 22 → CO2 + 2h2Ani
ΔH = -890.3 kJ/mol
To znamená, že jeden mol Cho4 Keď spaľovanie oslobodzuje 890.3 kJ kalorickej energie.
Hydrogenácia etylénu
Chvály2= CH2 + H2 → CH3Chvály3
ΔH = -136 kJ/mol
Mole etylénu uvoľňuje 136 kJ tepla, keď sa vodík stane etánom.
Soľ vo vode
Stolová soľ, NaCl, sa rozpustí vo vode, aby sa oddelili ióny+ a cl- kryštalických sietí a obklopuje (hydrát) molekúl vody:
NaCl (S) → NA+(Ac) + cl-(Ac)
ΔH = +3.87 kJ/mol
To znamená rozpúšťanie soli vo vode, podľa toho ochladiť sklo alebo nádobu. Avšak absorbované množstvo tepla je veľmi malé, takže naše ruky budú cítiť iba miernu zmenu teploty.
Rozpustenie chlorečného draselného vo vode
Na druhej strane, chloret draselný, KCLO3, Má ΔHDisk veľmi pozitívne:
KCL3(s) → k+(ac) + clo3-(Ac)
ΔH = +41.38 kJ/mol
Čo znamená, že sa rozpustí vo vode, absorbuje veľmi horúco. A preto sa nádoba výrazne ochladí a uvidíme, že okolitá vodná pary zvlhčí svoj vonkajší povrch.
Odkazy
- Whitten, Davis, Peck & Stanley. (2008). Chémia. (8. vydanie.). Učenie sa.
- Wikipedia. (2020). Entalpia. Zdroj: In.Wikipedia.orgán
- HelMestine, Anne Marie, PH.D. (28. augusta 2020). Definícia entalpie v chémii a fyzike. Zotavené z: Thoughtco.com
- Andrew Rader Studios. (2015). Energia. Obnovené z: fyziky4 kids.com
- Prekážať. (2020). Fakty o entalpiách pre deti. Zdroj: Fakty.Prekážať.co
- Správca. (21. decembra 2010). Entalpia. Obnovené z: oxyorganickej chemikálie.com
- María estela Raffino. (11. júla 2020). Koncept entapie. Získané z: koncepcie.z

