Trojnásobok
- 4586
- 1403
- Alfréd Blaho
Vysvetľujeme, čo je trojitý odkaz, jeho charakteristiky a uvádzame niekoľko príkladov
 Molekula acetylénu (C2H2) s jeho trojnásobnou väzbou medzi dvoma atómami uhlíka
Molekula acetylénu (C2H2) s jeho trojnásobnou väzbou medzi dvoma atómami uhlíka Čo je trojitý kovalentný odkaz?
Ten trojnásobné kovalentné putá Sú to chemické väzby, v ktorých dva atómy zdieľajú tri páry elektrónov. Inými slovami, sú to kovalentné väzby tvorené celkom šiestimi valenčnými elektrónmi, ktoré sa točia okolo dvoch atómov.
Existuje veľa chemických zlúčenín, ktoré obsahujú trojité odkazy. Napríklad organické zlúčeniny, ako napríklad alkynes, obsahujú trojité kovalentné väzby. Nitrily sa tiež vyznačujú tým, že majú skupinu, ktorá obsahuje uhlík spojený s dusíkom pomocou trojitej kovalentnej väzby C-N. Ostatné anorganické zlúčeniny, ako je molekulárny dusík vo vzduchu, tiež obsahujú trojité kovalentné väzby.
Mať 6 elektrónov, ktoré sa otáčajú okolo dvoch jadier. Tvar molekúl, ktoré ich obsahujú, a chemické reakcie, na ktorých sa môžu zúčastniť, sa líšia od tvarov dvojitých alebo jednoduchých väzieb.
Charakteristiky trojitého kovalentného odkazu
Tvoria ich 6 elektrónov
Tieto väzby sú tvorené 6 elektrónmi a tvoria sa, keď každý z dvoch zúčastnených atómov zdieľa tri z jeho zmiznutých elektrónov s ostatnými. To je dôvod, prečo sa nazývajú trojité odkazy, pretože majú trojnásobok počtu elektrónov jednoduchého kovalentného dlhopisu.
Majú Sigma Link (σ) a dve spojenia PI (π)
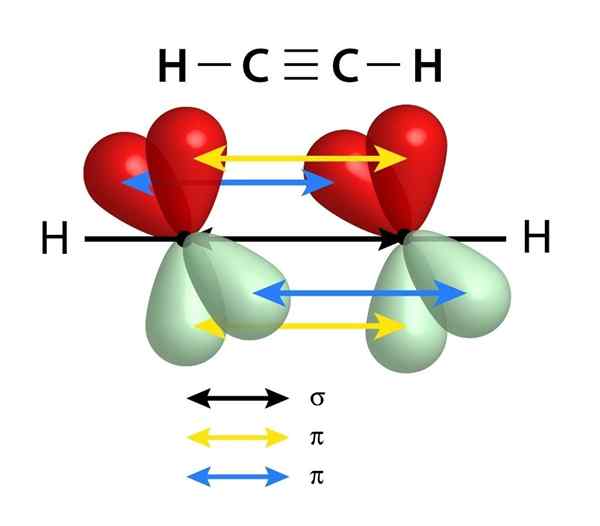 Schéma odkazov, ktoré tvoria trojnásobné spojenie medzi dvoma atómami uhlíka. Čierna šípka v strede predstavuje Sigma Link, zatiaľ čo žltá a modrá predstavuje každú z dvoch putov Pi
Schéma odkazov, ktoré tvoria trojnásobné spojenie medzi dvoma atómami uhlíka. Čierna šípka v strede predstavuje Sigma Link, zatiaľ čo žltá a modrá predstavuje každú z dvoch putov Pi Podobne ako v prípade dvojitých väzieb, trojité odkazy sú tiež tvorené Sigma Link, ktorý prechádza stredom riadku, ktorý sa spája s týmito dvoma prepojenými atómami. Avšak na rozdiel od dvojitých odkazov, ktoré majú jeden, majú trojité odkazy okrem odkazu Sigma dva odkazy na PI.
Môže vám slúžiť: chlorid meďnatého (i) (CUCL): Štruktúra, vlastnosti, použitiaTakmer vždy tvoria lineárne zlúčeniny
Keď dva atómy uhlíka tvoria trojité spojenie, každý z nich má stále možnosť vytvoriť ďalšie jednoduché spojenie s iným atómom (pretože uhlík môže tvoriť celkovo 4 väzby).
V týchto prípadoch budú dva uhlíky aj ďalšie dva atómy pripevnené k nim tvoria priamu čiaru. Táto forma, ktorú molekula získava, sa nazýva lineárna geometria.
Sú najsilnejšími kovalentnými väzbami
Pri porovnaní trojitých väzieb medzi dvoma atómami s dvojitými a jednoduchými väzbami medzi rovnakými atómami sa pozoruje, že trojité prepojenia sú vždy silnejšie ako ostatné typy kovalentnej väzby. To znamená, že je ťažšie prelomiť trojitý odkaz ako dvojitý alebo jednoduchý.
Dôvodom je, že okrem toho, že musíte prelomiť odkaz Sigma (ktorý je tiež prítomný v jednoduchých aj dvojitých väzbách), nesmie sa prelomiť (ako v dvojitých odkazoch), ale dve ďalšie PI Bonds.
Sú kratšie ako dvojité putá alebo také jednoduché
Kvôli rovnakej skutočnosti, že sú silnejšie odkazy, spravujú trojité odkazy.
Predstavujú dve nenasýtenie
Každý uhlík, ktorý má trojnásobnú väzbu, bude mať iba ďalšie spojenie s iným atómom. To znamená, že takýto uhlík by bol spojený iba s dvoma atómami namiesto štyroch, takže má menej vodíka, ako by mohol mať, keby vytvoril iba jednoduché väzby.
Môže vám slúžiť: Heptano (C7H16): Štruktúra, vlastnosti a použitiaToto sa nazýva nenasýtenie a zlúčeniny s trojitými odkazmi majú dve nenasýtenie, pretože každý z týchto dvoch uhlíkov by sa zmestil na 2 ďalšie hydrogény, ak nie pre trojitý odkaz.
Sú to pevné odkazy
Rovnako ako dvojité dlhopisy, aj trojité odkazy sú tuhé a ťažko sa ohýbajú alebo krútia. Je to kvôli väčšej sile spojenia a pri najnižšej dĺžke.
Môžu konať ako základy
Niektoré zlúčeniny s trojitými odkazmi môžu použiť PI elektróny uvedeného odkazu na prepojenie alebo akceptovanie H iónov+, Preto pôsobia ako základy.
Môžu ich vodíkom, aby poskytli dvojité alebo jednoduché odkazy
Nenasývanie trojitého spojenia je možné odstrániť prerušením väzieb PI a pridaním vodíkov do týchto dvoch uhlíkov. Toto sa nazýva hydrogenácia. Ak sa pridá iba molekula vodíka na trojnásobnú väzbu, stane sa dvojitou väzbou. Ak sa pridajú dve molekuly vodíka, stane sa jednoduchou väzbou.
Príklady trojitých kovalentných odkazov
Molekula dusíka (n2)
Molekula dusíka obsahuje trojitú kovalentnú väzbu medzi dvoma atómami dusíka. Každý atóm zdieľa svoje tri valenčné elektróny s ostatnými a každá nová pár elektrónov sa stáva väzbou Sigma alebo jednou z dvoch PI väzieb, ktoré má molekula.
 Molekula dusíka
Molekula dusíka V tomto prípade sú dva atómy dusíka a páry nezranených elektrónov, ktoré sú každé z nich umiestnené pozdĺž priamky.
Správne (alkyne receptúry C3H4)
Správne je druhý najjednoduchší alkíny, ktorý existuje. Táto zlúčenina sa skladá z trojharbónového reťazca, z ktorých dva sú spojené pomocou trojitého kovalentného spojenia.
Môže vám slúžiť: nenasýtené uhľovodíky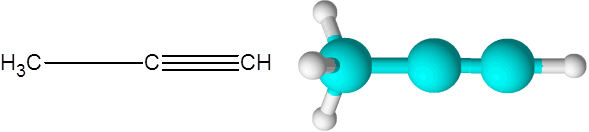 Molekula propino
Molekula propino Tu tiež vidíte, že tri uhlíky a posledný atóm vodíka (ten vpravo) tvoria priamu čiaru. V modeli je tiež zrejmé, že jednoduchý odkaz C-C je dlhší ako trojitý odkaz C-C.
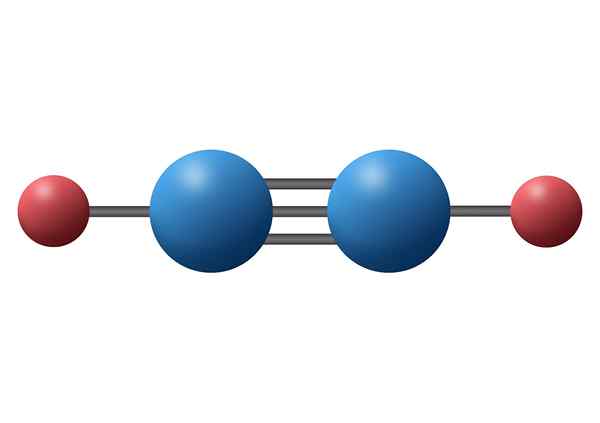
Oxid uhoľnatý (CO)
Oxid uhoľnatý je toxický anorganický plyn, ktorý má negatívny atóm uhlíka a pozitívny kyslík spojený pomocou trojitej kovalentnej väzby. V tomto prípade ide o polárnu väzbu kvôli rozdielu v elektronegativite medzi uhlíkom a kyslíkom.
 Molekula oxidu uhoľnatého
Molekula oxidu uhoľnatého

