Nepolárny kovalentný väzb
- 4598
- 932
- Alan Milota
Vysvetľujeme, čo je to ne -polárne kovalentné puto, jeho charakteristiky a niekoľko príkladov
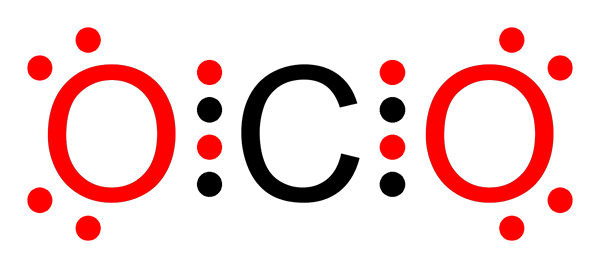
 Nepolárna kovalentná väzba oxidu uhličitého
Nepolárna kovalentná väzba oxidu uhličitého Čo je to ne -polárna kovalentná väzba?
A nepolárny kovalentný väzb, Tiež sa nazýva čistá alebo apolárna kovalentná väzba, je to únia dvoch atómov, ktoré zdieľajú jedno alebo viac párov elektrónov rovnako. Inými slovami.
Tento typ spojenia je medzi dvoma rovnakými atómami (rovnakého prvku) alebo medzi dvoma rôznymi atómami, ale ktoré majú veľmi podobné elektronegativity.
Existujú tri typy chemických spojení, ktoré si navzájom udržujú atómy. To sú: iónová väzba, kovalentná väzba a kovový odkaz. Tieto odkazy sa líšia podľa toho, ako sú elektróny distribuované okolo atómov.
V prípade kovalentných väzieb zdieľajú dva atómy valenčné elektróny, čo znamená, že tieto elektróny namiesto otáčania okolo atómu sa točia okolo týchto dvoch. Nie je to však vždy spravodlivé, pretože elektróny uprednostňujú trávenie viac času v blízkosti elektronického atómu, čo vedie k polárnym kovalentným dlhopisom.
V prípade nepolárnych kovalentných väzieb sa tak nestane, pretože obe atómy majú rovnakú elektronegativitu alebo veľmi podobné elektronegativity.
Charakteristiky nepolárneho kovalentného spojenia
1. Vytvárajú sa medzi atómami s rovnakými alebo veľmi podobnými elektronegativitami
Sú to kovalentné väzby, ktoré sa tvoria medzi rovnakými atómami alebo ktoré majú veľmi podobné elektronegativity. Vo všeobecnosti sa kovalentná väzba nepovažuje za polárnu, ak je rozdiel v elektronickej úrovni nižší alebo rovný 0,4.
Môže vám slúžiť: kyselina sukcinová: štruktúra, vlastnosti, získanie, použitia2. Môžu byť jednoduché, dvojité alebo trojnásobné
V závislosti od počtu párov elektrónov, ktoré zdieľajú oba atómy, nepolárne alebo apolárne kovalentné väzby môžu byť jednoduché, dvojité alebo trojnásobné.
Keď je väzba tvorená jediným párom elektrónov, nazýva sa jednoduchý odkaz, keď sa zdieľajú dva páry elektrónov, nazýva sa dvojitá väzba a ak sa zdieľajú tri páry elektrónov, nazýva sa Triple Link.
3. Takmer vždy zahŕňajú ne -metal
Kovy sú prvky s veľmi nízkymi elektronegativitami, ktoré navzájom tvoria kovové väzby. Keď sú spojené s net -metami, vždy tvoria iónové väzby alebo polárne odkazy. Z tohto dôvodu sa nepolárne kovalentné väzby tvoria iba medzi nemetalickými prvkami, ako je vodík a uhlík.
4. Vznikajú apolárne zlúčeniny
Zlúčenina, ktorá má iba nepolárne kovalentné väzby, sa vytvorí pomocou apolárnych molekúl. Tieto typy zlúčenín sa vyznačujú tým, že majú nízke teploty varu a fúzie v porovnaní s kovmi a iónovými zlúčeninami (niektoré sú dokonca aj plyny pri teplote miestnosti), sú nerozpustné vo vode a sú zlými vodičmi tepla a elektriny.
5. Môžu tvoriť tuhé, kvapalné alebo plynné zlúčeniny pri teplote miestnosti
Zlúčeniny s nepolárnymi kovalentnými väzbami môžu mať nízke, ale veľmi rozmanité varné a fúzne body.
Z tohto dôvodu sú niektoré z nich plyny pri izbovej teplote (napríklad vodík, h2, a dusík, n2), iné sú tekutiny (napríklad Bromo, Br2), zatiaľ čo iné sú pevné (napríklad naftalén, c10H8).
6. Majú relatívne nízke energie spojenia.
V porovnaní s iónovými odkazmi sa ľahšie prelomia ne -polárne kovalentné väzby, pretože majú nižšiu energiu spojenia. To znamená, že na prelomenie nepolárnej kovalentnej väzby musíte použiť menej energie ako iónová väzba.
Môže vám slúžiť: Stoichiometrické zákonyPríklady nepolárnych kovalentných odkazov
H-H spojenie v molekule vodíka (H2)
V molekule vodíka, h2, Dva atómy vodíka zdieľajú svoje jediné valenčné elektróny, aby vytvorili jednoduchú kovalentnú väzbu.
 Molekula vodíka
Molekula vodíka Pretože obidva atómy sú rovnaké, rozdiel v elektronických obdobiach medzi nimi bude nula, takže toto spojenie je nepolárna kovalentná väzba.
F-F Link v molekule fluóru (F2)
Tento príklad zdôrazňuje skutočnosť, že nezáleží na elektronickejpativite atómu, ale rozdiel v elektronických účinkoch dvoch atómov, ktoré tvoria odkaz, aby vedeli, či bude spojenie kovalentné, nie polárne alebo nie.
 Molekula fluóru
Molekula fluóru Fluór je najviac elektronegatívny prvok periodickej tabuľky, takže má tendenciu odstraňovať svoje elektróny z ostatných prvkov, aby tvorili polárne alebo iónové väzby.
Ak je však atóm fluoridu spojený s iným, čo sa s ním rovná, nemôže odstrániť elektróny z druhého (neexistuje žiadny rozdiel v elektronegativite), takže nemajú inú možnosť, ako ich zdieľať a vytvárať sa tak, a tak sa formovať, a neolárne kovalentné spojenie.
O-O odkazy v molekule ozónu (alebo3)
Rovnako ako v prípade molekuly fluóru, kyslík je tiež veľmi elektronegatívnym prvkom. Avšak vytvorením odkazov s inými atómami kyslíka tvorí nepolárne kovalentné väzby. To je prípad molekuly ozónu.
 Molekula ozónu
Molekula ozónu V tomto prípade je centrálny atóm kyslíka spojený s dvoma ďalšími atómami kyslíka pomocou nepolárnych alebo apolárnych kovalentných väzieb.
Môže vám slúžiť: oxid horečnatý: štruktúra, vlastnosti, nomenklatúra, použitiaN-n Link v molekule dusíka (n2)
Molekula dusíka obsahuje nepolárnu kovalentnú väzbu, v ktorej každý atóm dusíka zdieľa svoje tri valenčné elektróny s ostatnými zmiznutými.
 Molekula dusíka
Molekula dusíka Z tohto dôvodu obidva atómy zdieľajú celkom tri páry elektrónov, čím vytvárajú trojitú kovalentnú väzbu.
C-H odkazy v molekule metánu (CH4)
Metán je príkladom nepolárnej kovalentnej väzby vytvorenej medzi atómami rôznych prvkov, v tomto prípade uhlíkom a vodíkom.
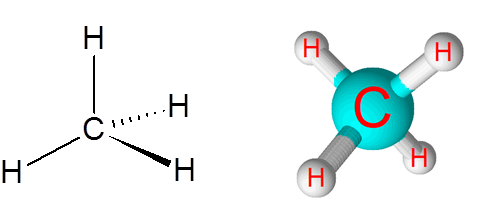 Molekula metánu
Molekula metánu Rozdiel v elektronegativite medzi týmito dvoma prvkami je 0,4, ktorý umiestňuje túto hranicu iba medzi nepolárnymi a polárnymi väzbami.
Link C = C v molekule etylénu (C2H4)
Molekula etylénu, tiež nazývaná eteno, má celkom päť spojení. Štyri odkazy C-H a dvojitá väzba C = C. V obidvoch prípadoch odkazy zodpovedajú nepolárnym alebo apolárnym kovalentným väzbám.
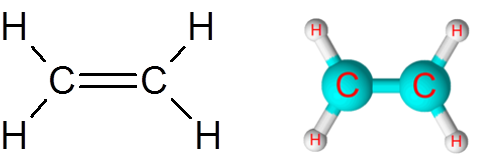 Molekula etylénu
Molekula etylénu
- « 6 tancov a tance typické pre Quintana Roo slávnejšie
- 9 tancov a typické tance Michoacána slávnejšie »

