Kovalentná väzba

- 3339
- 89
- Adrián Fajnor
Vysvetľujeme, čo je dvojité kovalentné puto, jeho charakteristiky a uvádzame niekoľko príkladov
 Molekula eteno alebo etylénu. Je to typický príklad dvojitej kovalentnej väzby medzi dvoma atómami uhlíka
Molekula eteno alebo etylénu. Je to typický príklad dvojitej kovalentnej väzby medzi dvoma atómami uhlíka Čo je to dvojitá kovalentná väzba?
Ten dvojité kovalentné väzby Sú to chemické väzby, v ktorých dva atómy zdieľajú dva páry elektrónov. Inými slovami, sú to kovalentné väzby tvorené celkom štyrmi valenčnými elektrónmi, ktoré sa točia okolo dvoch atómov.
Dvojité odkazy sú v organických zlúčeninách veľmi bežné. Napríklad všetky alkény majú dvojitú väzbu z uhlíka-uhlíka. Mnoho ďalších funkčných skupín, ako sú aldehydy, ketóny, karboxylové kyseliny a amidy, má tiež dvojité kovalentné väzby medzi uhlíkom a kyslíkom. Iné, ako napríklad imin, majú dvojité kovalentné väzby C = n.
Dvojité odkazy majú veľa charakteristík, ktoré ich odlišujú od iných typov kovalentných dlhopisov, ako sú jednoduché odkazy a trojité odkazy. Líšia sa vo forme molekúl, ktoré ich obsahujú, v dĺžke a prepojenej sile a ďalších charakteristikách súvisiacich s ich chemickými vlastnosťami.
Dvojité kovalentné charakteristiky spojenia
Tvoria ich 4 elektróny
Dôvod, prečo sú dvojité väzby, pretože obsahujú dvojité elektróny jednoduchej kovalentnej väzby, ktorá sa tvorí, keď dva atómy zdieľajú dva valenčné elektróny. To znamená, že každá dvojitá väzba obsahuje 4 elektróny.
Sú tvorené spojením Sigma (σ) a spojením PI (π)
Zo 4 elektrónov, ktoré tvoria dvojitú väzbu, 2 z nich idú a prichádzajú medzi jeden atóm a druhý, prechádzajúc stredom týchto dvoch. Tento pár elektrónov sa nazýva elektróny Sigma, pretože tvoria Sigma väzbu (σ).
Druhý pár elektrónov sa vznáša nad a pod dvoma atómami a vytvára druh sendviča. Tieto elektróny sa nazývajú Elektróny PI a tvoria spojenie PI (π).
Môže vám slúžiť: chlórbenzén (C6H5Cl)Spoločne Sigma Link a PI Link tvoria dvojitú kovalentnú väzbu.
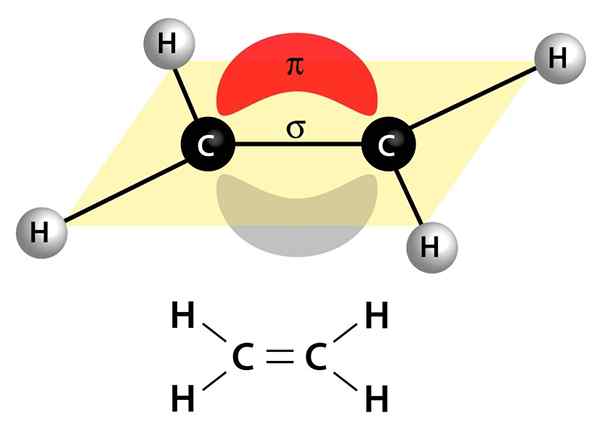 Tento obrázok zobrazuje dva odkazy, ktoré tvoria dvojitú väzbu: Link PI, ktorý sa javí ako červený a šedý oblak, ktorý je nad a pod molekulou, a Sigma Link, ktorý je líniou, ktorá spája obe jadrá cez stred
Tento obrázok zobrazuje dva odkazy, ktoré tvoria dvojitú väzbu: Link PI, ktorý sa javí ako červený a šedý oblak, ktorý je nad a pod molekulou, a Sigma Link, ktorý je líniou, ktorá spája obe jadrá cez stred Môžu byť polárne alebo apolárne
V závislosti od elektronegativity atómov, ktoré sú spojené pomocou dvojitého kovalentného väzby, môže byť polárny alebo apolárny.
Napríklad dvojitá kovalentná väzba C = c Bude to apolárne spojenie, pretože oba atómy sú rovnaké a majú rovnakú elektronegativitu. Namiesto toho dvojitá kovalentná väzba C = O Bude to polárne, pretože kyslík je oveľa elektronegatívnejší ako uhlík.
Sú silnejšie ako jednoduché odkazy
Prerušenie dvojitého puto je ťažšie ako prelomenie jednoduchého spojenia medzi rovnakými dvoma atómami. Dôvodom je, že na prelomenie dvojitého spojenia sa musí prerušiť spojenie Sigma (ktoré sa rovná jednoduchému odkazu) a spojenie PI musí byť prerušené. Pretože namiesto jedného musia byť rozdelené dve odkazy, dvojité puto je silnejšie ako jednoduché.
Sú slabšie ako trojité odkazy
V porovnaní s Triple Link je dvojité puto slabšie a ľahšie sa rozbije. Dôvod je rovnaký ako predtým, iba to, že v tomto prípade má dvojité dlhopisy menej odkazov ako zlomenie v porovnaní s trojitým odkazom.
Sú kratšie ako jednoduché odkazy
Keďže sú silnejšie odkazy ako jednoduché odkazy, dvojité putá sú schopné priblížiť prepojené atómy ako jednoduché odkazy ako jednoduché odkazy. Z tohto dôvodu, ak je spojenie s dvojitým c = c porovnané s jednoduchým odkazom C-C, prvý je vždy kratší ako druhý.
Môže vám slúžiť: tiosulfát sodný (Na2S2O3)Sú dlhšie ako trojité odkazy
Keď je trojitý odkaz silnejší ako dvojitý odkaz, trojitý odkaz je kratší. To znamená, že dvojité kovalentné väzby sú dlhšie ako trojnásobok.
Sú to pevné odkazy.
Jednoduché kovalentné väzby sú dosť flexibilné a môžu sa tiež otáčať. Na druhej strane, dvojité väzby sú tuhé, nie sú flexibilné a nemožno sa otáčať, pretože prepojenie PI, ktoré bolo uvedené vyššie.
Predstavujú nenasýtenie
Molekula, ktorá má dvojitú väzbu, bude mať dva menej spojené atómy vodíka, ako by mohla mať. Z tohto dôvodu sa uvádza, že dvojitá väzba predstavuje nenasýtenie (každé nenasýtenie zodpovedá 2 vodíkom).
Tvoria molekuly s plochým trojuholníkom
Atóm uhlíka, ktorý tvorí dvojitú kovalentnú väzbu a ďalšie dve jednoduché väzby, vždy tvorí plochú molekulu, v ktorej tieto tri väzby smerujú k koncom trojuholníka. Táto forma sa nazýva plochá trigonálna geometria.
Príklady dvojitých kovalentných väzieb
Link C = C v etyléne
Etylén je jedným z najjednoduchších príkladov dvojitej kovalentnej väzby, v tomto prípade medzi dvoma atómami uhlíka.
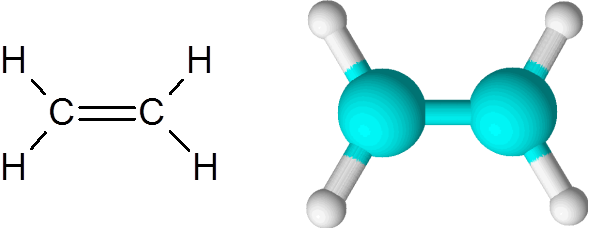 Molekula etylénu
Molekula etylénu Molekula je úplne plochá a nie je možné otáčať spojenie v žiadnom smere. Táto dvojitá väzba je úplne apolar, pretože spája dva rovnaké atómy.
Odkaz C = o v acetone
Všetky ketóny obsahujú karbonylovú skupinu, ktorá pozostáva z atómu uhlíka a atómu kyslíka United pomocou dvojitej kovalentnej väzby.
Môže vám slúžiť: Čo je chemická kinetika?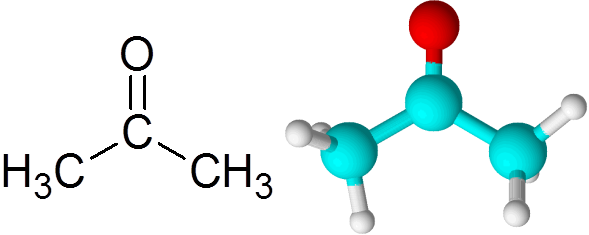 Acetón
Acetón Každý atóm prispieva dvom chýbajúcim elektrónom, aby vytvorili Link PI aj Sigma, ktoré tvoria dvojitú väzbu. Väčšina chemických reakcií, ktoré sa vyskytujú na ketónoch, je spôsobená dvojitou väzbou C = o.
Odkaz O = alebo v molekule ozónu (alebo3)
V tomto prípade je centrálny atóm kyslíka spojený s dvoma ďalšími atómami kyslíka. Jedna z týchto dvoch väzieb je tvorená 4 elektrónmi, takže zodpovedá dvojitej kovalentnej väzbe. Tri atómy a pár elektrónov bez zdieľania, ktoré majú atóm centrálneho kyslíka, sú všetky v rovnakej rovine obrazovky smerujúce k rohom trojuholníka.
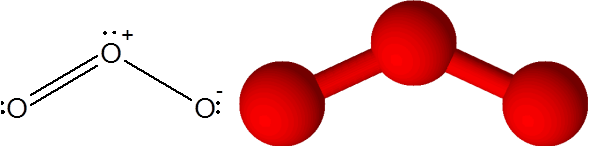 Molekula ozónu
Molekula ozónu Ozón má zvláštnosť, že dvojité puto môže „skočiť“ z jedného z terminálových kyslíka na druhý. V skutočnosti to robí veľmi rýchlo prostredníctvom procesu nazývaného rezonancia.
C = c odkazy v butadieno (C4H6)
Butadieno je príkladom organickej zlúčeniny, ktorá má dve dvojité kovalentné väzby C = C.
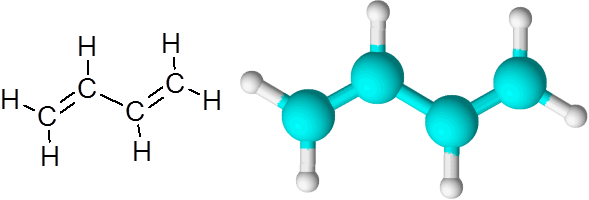 1,3-butadién molekula
1,3-butadién molekula Keď sú dvojité väzby týmto spôsobom, oddelené jediným jednoduchým odkazom, hovorí sa, že sú konjugované dvojité odkazy.

