Koordinovaná kovalentná väzba
- 2470
- 223
- JUDr. Rudolf Čapkovič
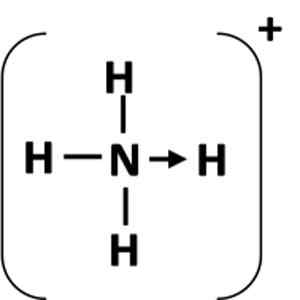
 Obrázok 1: Zastúpenie koordinačného spojenia medzi atómom darcu (N) a akceptorom (H).
Obrázok 1: Zastúpenie koordinačného spojenia medzi atómom darcu (N) a akceptorom (H). Čo je koordinované kovalentné spojenie?
A koordinovaná kovalentná väzba, alebo koordinačný odkaz jeTyp spojenia, v ktorom jeden z atómov dodáva všetky zdieľané elektróny. Nazýva sa to aj dative alebo bipolárne spojenie.
V jednoduchom kovalentnom spojení každý atóm dodáva elektrón na odkaz. Na druhej strane, v koordinačnom spojení jeden atóm daruje elektróny na vytvorenie spojenia a nazýva sa atóm darcu, zatiaľ čo atóm, ktorý akceptuje dvojicu elektrónov, sa nazýva akceptorový atóm.
Koordinačné spojenie predstavuje šípka, ktorá začína od atómov dávania a končí v atóme akceptora (obrázok 1). V niektorých prípadoch môže byť darcom molekula.
V tomto prípade môže atóm v molekule darovať dvojicu elektrónov, ktoré by boli základňou Lewisa, zatiaľ čo molekula s akceptorovou kapacitou by bola Lewisová kyselina.
Koordinačné spojenie má podobné vlastnosti ako v prípade jednoduchej kovalentnej väzby. Zlúčeniny, ktoré majú tento typ spojenia, majú zvyčajne nízky bod topenia a varu, s neexistujúcou coulombickou interakciou medzi atómami (na rozdiel od iónovej väzby) a zlúčeniny sú veľmi rozpustné vo vode veľmi rozpustné.
Niektoré príklady koordinovaných kovalentných odkazov
Najbežnejším príkladom koordinačného spojenia je amónny ión, ktorý je tvorený kombináciou molekuly amoniaku a protón z kyseliny.
Môže vám slúžiť: Chemická rovnica: časti a príkladyV amoniaku má atóm dusíka po dokončení oktetu osamelý pár elektrónov. Urobil tento osamelý pár s vodíkovým iónom, takže atóm dusíka sa stáva darcom. Atóm vodíka sa stáva akceptorom.
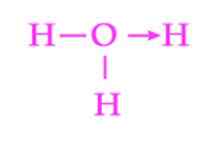 Obrázok 2: Zastúpenie koordinačného spojenia hydronio iónov
Obrázok 2: Zastúpenie koordinačného spojenia hydronio iónov Ďalším spoločným príkladom dativého spojenia je tvorba hydrónskeho iónu. Rovnako ako v prípade iónu amoniak, aj pár voľných elektrónov molekuly vody slúži ako darca k protónu, ktorý je akceptorom (obrázok 2).
Je však potrebné pamätať na to, že po vytvorení koordinačného spojenia sú všetky hydrogény pripojené k kyslíku presne rovnocenné. Keď sa vodíkový ión znova rozbije, nedochádza k rozlišovaniu, ktorá z vodíkov sa uvoľňuje.
Vynikajúcim príkladom kyslej kyslej reakcie, ktorá ilustruje tvorbu koordinovanej kovalentnej väzby, je tvorba reakcie bóru trifluoridového aduktu s amoniakom.
Boro trifluorid je zlúčenina, ktorá nemá okolo Boro Atom štruktúru ušľachtilého plynu. Bór má vo svojej valenčnej vrstve iba 3 páry elektrónov, takže sa hovorí, že BF3 má nedostatok elektrónov.
Na prekonanie tohto nedostatku sa môže použiť krútiaci moment dusíka dusíka a tvorí sa zlúčenina, ktorá znamená koordinačné spojenie.
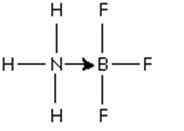 Obrázok 3: Adukt medzi molekulami trifluoridu bóru a amoniakom
Obrázok 3: Adukt medzi molekulami trifluoridu bóru a amoniakom Že pár dusíkových elektrónov je darovaný orbitálnej p prázdnym bórom. Tu je amoniak základom Lewisa a BF3 je Lewisova kyselina.
Môže vám slúžiť: dusíkový valenciaKoordinačná chémia
Existuje odvetvie anorganickej chémie venovanej výlučne štúdiu zlúčenín, ktoré tvoria prechodné kovy. Tieto kovy sa viažu na iné atómy alebo molekuly prostredníctvom koordinačných väzieb za vzniku komplexných molekúl.
Tieto molekuly sú známe ako koordinačné zlúčeniny a veda, ktorá ich študuje, sa nazýva koordinačná chémia.
V tomto prípade je látka spojená s kovom, ktorým by bol elektrónový darček, známa ako ligácia a bežne koordinačné zlúčeniny sú známe ako komplexy.
Koordinačné zlúčeniny zahŕňajú látky, ako je vitamín B12, hemoglobín a chlorofyl, farbivá a pigmenty a katalyzátory používané pri príprave organických látok.
Príkladom komplexného iónu by bol kobaltový komplex [CO (NH2Chvály2Chvály2NH2) 2clnh3]2+ To by bol kobalt Dichlóaminetylandiamín (IV).
Koordinačná chémia vznikla z práce Alfreda Wernera, švajčiarskeho chemika, ktorý skúmal rôzne zlúčeniny chloridu kobaltu (III) a amoniak. Po pridaní kyseliny chlorovodíkovej, Werner pozoroval, že amoniak sa nedá úplne vylúčiť. Potom navrhol, že amoniak by mal byť viac spojený s centrálnym kobaltovým iónom.
Keď sa však pridal vodný dusičnan strieborný, jedným z vytvorených produktov bol chlorid solídneho striebra. Množstvo vytvoreného strieborného chloridu súviselo s počtom molekúl amoniaku spojených s chloridom kobaltu (III).
Napríklad, keď sa do COCL pridal dusičnan strieborný dusičnan3 · 6h3, Tri chloridy sa stali chloridom striebra.
Keď sa však do COCL pridal dusičnan strieborný dusičnan3 · 5nh3, Iba 2 z 3 chloridov tvorili chlorid strieborného. Keď to bolo Cocl3.4 nh3 S dusičnanom striebra, jeden z troch chloridov vyzrážaných ako chlorid strieborného.
Môže vám slúžiť: kyselina píchrová: čo je, štruktúra, syntéza, vlastnostiVýsledné pozorovania naznačujú tvorbu komplexných zlúčenín alebo koordinácie. Vo vnútornej koordinačnej sfére, ktorá sa v niektorých textoch označuje aj ako prvá guľa, sú ligandy priamo spojené s centrálnym kovom.
Vo vonkajšej koordinačnej sfére, niekedy nazývanej druhá guľa, sú k komplexnému iónu pripevnené ďalšie ióny. Werner získal Nobelovu cenu v roku 1913 za svoju teóriu koordinácie.
Táto teória koordinácie spôsobuje, že prechodné kovy majú dva typy Valencie: prvá Valencia, určená oxidačným číslom kovu a ďalšie Valencia nazývané koordinačné číslo.
Oxidačné číslo hovorí, koľko kovalentných väzieb je možné tvoriť v kovu (príklad, železo (ii) produkuje škaredé) a koordinačné číslo hovorí, koľko koordinačných odkazov je možné vytvoriť v komplexe (príklad, železo s koordinačným číslom 4, produkuje [FECL4]- a [fecl4]2-).
V prípade kobaltu má koordinačné číslo 6. Preto vo Wernerových experimentoch, pridanie dusičnanu striebra, sa vždy získalo množstvo chloridu striebra, ktorý zanechal hexakoordinovaný kobalt.
Koordinačné odkazy tohto typu zlúčeniny majú charakteristiku farby.
V skutočnosti sú zodpovedné za typické sfarbenie spojené s kovom (červené železo, modrý kobalt atď.) a sú dôležité pre spektrofotometrické skúšky absorpcie a atómovej emisie.
Odkazy
- Chemická väzba. Zotavené z Britannice.com.
- Koordinovať kovalentnú väzbu (s.F.). Získané z chémie.Lektorka.

