Helmholtz Free Energy Units, ako sa vypočítava, vyriešené cvičenia

- 2582
- 522
- Tomáš Mydlo
Ten Helmholtzová voľná energia Je to termodynamický potenciál, ktorý meria užitočnú prácu uzavretého systému v podmienkach konštantnej teploty a objemu. Helmholtzova voľná energia je označená ako F A je definovaný ako rozdiel od vnútornej energie Alebo menej teplotný produkt Tón Pre entropiu Siež:
F = u - tells
Pretože ide o energiu, meria sa v jouloch v medzinárodnom systéme (SI), hoci ostatnými vhodnými jednotkami môžu byť Ergios (CGS), kalórie alebo elektrónové volty (EV).
 postava 1. Definícia Helmholtzovej energie. Zdroj: Pixabay.
postava 1. Definícia Helmholtzovej energie. Zdroj: Pixabay. Negatívna variácia Helmholtzovej energie počas procesu sa rovná maximálnej práci, ktorú môže systém vykonávať v izokorickom procese, tj konštantnom objeme. Ak objem nie je konštantný, časť tejto práce sa dá vykonať na životnom prostredí.
V tomto prípade sa odvoláme na prácu, v ktorej sa objem nemení, napríklad elektrická práca: dw = φdq, s φ ako elektrickým potenciálom a q ako elektrický náboj.
Ak je teplota tiež konštantná, Helmholtzova energia sa pri dosiahnutí rovnováhy minimalizuje. Za to všetko je Helmholtzova energia obzvlášť užitočná v procesoch konštantného objemu. V takom prípade máte:
- Pre spontánny proces: ΔF < 0
- Keď je systém v rovnováhe: ΔF = 0
- V nepontánnom procese: ΔF> 0.
[TOC]
Ako sa počíta Helmholtz Free Energy?
Ako sa uvádza na začiatku, Helmholtzova energia je definovaná ako „vnútorná energia alebo systém, s výnimkou produktu systému absolútnej teploty systému, entropickými systémami“:
F = u - tells
Je to funkcia teploty t a objemu V. Kroky na vizualizáciu sú nasledujúce:
Môže vám slúžiť: vnútorné elektróny- Počnúc prvým zákonom termodynamiky, vnútornou energiou alebo súvisí s entropickými systémami a jeho objemom V pre reverzibilné procesy prostredníctvom nasledujúceho diferenciálneho vzťahu:
du = dq - dw = tds - pdv
Z toho vyplýva, že vnútorná energia alebo je funkciou premenných Siež a Vložka, preto:
U = u (s, v)
- Teraz definícia F A je odvodený:
df = du - d (ts) = du - tds - sdt
- Nahrádza tam diferenciálny výraz získaný pre DU v prvom kroku, zostáva:
Df = tds - pdv - tds - sdt = -sdt - pdv
- Nakoniec sa dospelo k záveru, že F je funkciou teploty t a objemu V a dá sa vyjadriť ako:
F = f (t, v)
 Obrázok 2. Hermann von Helmholtz (1821-1894), nemecký fyzik a lekár, uznaný za jeho príspevky k elektromagnetizmu a termodynamike, medzi inými oblasťami vedy. Zdroj: Wikimedia Commons.
Obrázok 2. Hermann von Helmholtz (1821-1894), nemecký fyzik a lekár, uznaný za jeho príspevky k elektromagnetizmu a termodynamike, medzi inými oblasťami vedy. Zdroj: Wikimedia Commons. Spontánne procesy
Helmholtzova energia sa dá aplikovať ako všeobecné kritérium spontánnosti v izolovaných systémoch, ale predtým, ako by sa mali špecifikovať niektoré koncepty:
- A zatvorený systém Môže si vymieňať energiu s životným prostredím, ale nemôže si vymeniť záležitosť.
- Namiesto a izolovaný systém nevymieňa si hmotu ani energiu s životným prostredím.
- Konečne a otvorený systém výmenná hmota a energia s životným prostredím.
 Obrázok 3. Termodynamické systémy. Zdroj: Wikimedia Commons. Fjgar (BIS) [CC BY-SA (https: // creativeCommons.Org/licencie/By-SA/4.0)].
Obrázok 3. Termodynamické systémy. Zdroj: Wikimedia Commons. Fjgar (BIS) [CC BY-SA (https: // creativeCommons.Org/licencie/By-SA/4.0)]. V reverzibilných procesoch sa zmeny vnútornej energie vypočítava nasledovne:
DU = TDS - PDV
Teraz predpokladajme proces konštantného objemu (izokorka), v ktorom má druhý termín predchádzajúceho výrazu neplatný príspevok. Treba tiež pamätať na to, že podľa Clausius Nerovnosť:
DS ≥ DQ/T
Takáto nerovnosť sa vzťahuje na izolovaný termodynamický systém.
Takže pre proces (reverzibilný alebo nie), v ktorom je objem udržiavaný konštanta, je splnená:
Môže vám slúžiť: kyselina fosforečná (H3PO4)T ds ≥ du (Pri pevnom objeme)
Berúc do úvahy to:
df = du - t ds
Budeme musieť v izokorickom procese pri konštantnej teplote splniť, že: Df ≤ 0, Ako je uvedené na začiatku.
Takže energia Helmholtz F je v spontánnom procese klesajúce množstvo, zatiaľ čo je to izolovaný systém. F dosiahne svoju minimálnu a stabilnú hodnotu, keď sa dosiahne reverzibilná rovnováha.
Vyriešené cvičenia
Cvičenie 1
Vypočítajte variáciu voľnej energie Helmholtz F pre 2 móly ideálneho plynu pri teplote 300 000 počas izotermálnej expanzie, ktorá vedie k systému počiatočného objemu 20 litrov do konečného objemu 40 litrov.
Riešenie
Počnúc definíciou F:
F = u - t s
Potom bude konečná variácia F, nazývaná AF, bude:
ΔF = ΔU - T ΔS
Ako sa uvádza, že teplota je konštantná: Δt = 0. V ideálnych plynoch však vnútorná energia závisí iba od jej absolútnej teploty, ale keďže ide o izotermálny proces, potom ΔU = 0 a Δf = - t δs. V prípade ideálnych plynov je takto napísaná variácia entropie izotermálneho procesu:
Δs = n.R.LN (v2/V1)
Uplatňovanie tohto výrazu:
ΔS = 2 mol x 8 314 j/(k mol) x ln (40L/20L) = 11,53 j/k
Nakoniec je zmena v Helmholtzovej energii:
Δf = - t δs = - 300k x 11,53 j/k = -3457,70 j.
Cvičenie 2
Vo vnútri valca je piest, ktorý ho rozdeľuje na dve časti a na každej strane piest n móly ideálneho monoatomického plynu, ako je znázornené na obrázku nižšie.
Steny valca sú dobré tepelné vodiče (diatermické) a sú v kontakte s teplotou T teploty Tani.
Počiatočný objem každej z sekcií valca je V1i a v2i, zatiaľ čo jeho posledné zväzky sú V1F a v2f Po kvázerskom výtlaku. Piest sa pohybuje pomocou piestom, ktorý hermeticky prechádza cez dva valec tapas.
Môže vám slúžiť: Tecnocio (TC): Štruktúra, vlastnosti, použitia, získanieŽiada sa, aby ste našli:
a) Zmena vnútornej energie plynu a práce vykonávané systémom a
B) Helmholtzova energetická variácia.
Roztok
Keď sa piest pohybuje kvázneticky, vonkajšia sila aplikovaná na piest musí vyvážiť silu v dôsledku tlakového rozdielu v dvoch častiach valca.
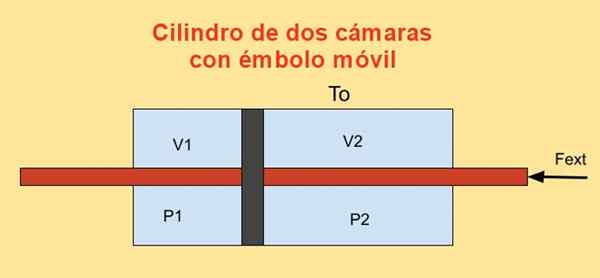 Obrázok 4. Variácia voľnej energie F vo valci s dvoma fotoaparátmi. Zdroj: f. Zapata.
Obrázok 4. Variácia voľnej energie F vo valci s dvoma fotoaparátmi. Zdroj: f. Zapata. Práca Dw Vyrobené externou silou Frozšíriť počas nekonečného posunu Dx je:
Dw = - frozšíriť Dx = (P1 - P2) Dx = p1 DV1 + P2 DV2
Kde sa vzťah použil DV1 = - dv2 = Dx, bytosť do Piestová oblasť. Na druhej strane variácia Helmholtzovej energie je:
Df = -sdt - pdv
Pretože počas procesu sa teplota nemení, potom dt = 0 a Df = - pdv. Aplikácia tohto výrazu na každú časť valca, ktorú máte:
dw = P1 DV1 + P2 DV2 = - df1 - Df2
Bytosť F1 a F2 Helmholtzove energie v každej z kamier.
Konečnú prácu W sa dá vypočítať z konečnej variácie Helmholtzovej energie každej kamery:
W = -Af1 - ΔF2
Riešenie B
Na nájdenie zmeny energie z Helmholtzu sa používa definícia: F = u - t s. Rovnako ako v každom fotoaparáte máte pri konštantnej teplote ideálny monoatomický plyn Tónani, Vnútorná energia sa nemení (ΔU = 0), takže: Δf = - tani ΔS. Okrem::
Δs = nr ln (vF/Píla)
To, že jej nahradením konečne umožňuje vykonanú prácu, je:
W = -tani Nr Ln (v1F /V1i) -do nr ln (v2f /V2i) = -Af1 -ΔF2
W = - až nr ln [(v1F ⋅ V1i)/(V2f .Vložka2i)] = - δfCelkom
Bytosť ΔFCelkom Celková variácia Helmholtzovej energie.
Odkazy
- Castaños e. Bezplatné energetické cvičenia. Získané z: Lidiaconlachimica.Slovník.com
- Librettexts. Helmholtz Energy. Získané z: Chem.Librettexts.orgán
- Librettexts. Čo sú bezplatná energia. Získané z: Chem.Librettexts.orgán
- Wikipedia. Helmholtz Energy. Obnovené z: je.Wikipedia.com
- Wikipedia. Helmholtzová voľná energia. Zdroj: In.Wikipedia.com

