Vnútorná energia
- 2474
- 99
- Adrián Fajnor
Vysvetlíme, čo je vnútorná energia, jej funkcia, ako ju vypočítať a uviesť niekoľko príkladov
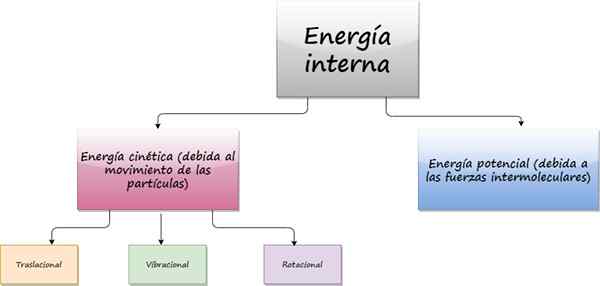
 Diagram ukazujúci príspevky k vnútornej energii systému. Zdroj: f. Zapata
Diagram ukazujúci príspevky k vnútornej energii systému. Zdroj: f. Zapata Čo je vnútorná energia?
Ten vnútorná energia Z objektu pochádza z náhodného pohybu, že atómy a molekuly, ktoré ho tvoria. Aj keď je objekt dokonale v pokoji, vo vnútri, na mikroskopickej úrovni, častice, ktoré ho tvoria nepretržite, sa pohybujú nepretržite bez odpočinku.
Pretože sa tieto častice pohybujú, majú kinetickú energiu, ktorá je súčasťou ich vnútornej energie. Ďalším prínosom k vnútornej energii je potenciálna energia, ktorá pochádza z intermolekulárnych síl, zodpovedných za udržiavanie súdržnosti látky.
Tieto intermolekulárne sily majú zvyčajne elektromagnetický pôvod, ale zúčastňujú sa aj gravitačné a jadrové sily.
Teraz, v závislosti od typu pohybu častíc, môže byť kinetická energia:
- Prekladací
- Vibrujúci
- Rotačný
Teplota meria iba translačnú kinetickú energiu častíc. V zásade bude pri väčšej teplote vnútorná energia väčšia, ale záleží to aj na hmotnosti. A príklad Problém sa objasňuje: sklo s teplou vodou má menšiu vnútornú energiu ako jazero pri izbovej teplote, hoci teplota skla je vyššia, a to preto, že v jazere je viac vody ako v skle.
V žiadnom prípade nie je viditeľná vnútorná energia látky, nezávisí od jej pohybu, ani nezávisí od jej relatívnej polohy vzhľadom na iné objekty. Napríklad vnútorná energia skla s vodou pri teplote miestnosti je rovnaká, ak je sklo na stole alebo ak je na podlahe.
Môže vám slúžiť: Non -coplanárne vektory: Definícia, podmienky, cvičeniaFunkcia vnútornej energie
Vnútorná energia, ktorá sa zvyčajne označuje ako u, je funkcia, ktorá závisí od termodynamických premenných systému, ako je teplota T a objem V. Preto sa dá matematicky vyjadriť ako:
U = u (t, v)
V skutočnosti nie je relevantná absolútna hodnota vnútornej energie systému, na čom záleží, je jeho variácia, ktorá je označená gréckym písmenom δ („delta“):
ΔU = u počiatočný - Alebo Konečný
Teraz sa môže vnútorná energia meniť, ak sa teplo pridáva alebo extrahuje. Pridanie tepla je možné, že systém vykonáva určitú prácu, napríklad piest vo valci motora.
Prvý zákon termodynamiky
Z prvého zákona termodynamiky sa preukázalo, že Variácia vnútornej energie Od systému ekvivalentu k:
ΔU = q - w
Kde je množstvo tepla, ktoré sa prenáša do systému a W je práca, ktorú systém robí, v prípade, že vykoná niektoré. Všetko sa meria v jouloch v medzinárodnom systéme jednotiek.
Ak systém nefunguje, dodávané teplo sa použije ako celok na zvýšenie vnútornej energie systému.
Nasleduje nasledujúce z predchádzajúceho výrazu:
- ΔU> 0 znamená, že systém zvyšuje svoju vnútornú energiu
- ΔU < 0 la energía interna del sistema disminuye
- Q> 0 Systém absorbuje teplo
- W> 0 Systém funguje.
Ako vypočítať vnútornú energiu?
Monoatomický ideálny plyn
V modeli monoatomického ideálneho plynu (jeden atóm) sa častice vzájomne interagujú, takže translačná kinetická energia je jediným príspevkom k vnútornej energii alebo plynu. Existuje veta, ktorá sa volá Vybavenka, ktorý uvádza, že každý stupeň slobody má energiu rovnú::
Môže vám slúžiť: difrakcia vlny: koncept a príkladyKde T je teplota a R je konštanta ideálnych plynov, ktorých hodnota jednotiek medzinárodného systému je:
8.314472 j/mol ∙ k
Stupeň slobody predstavuje možnosť pohybu v určitom smere vo vesmíre. Častica ideálneho plynu sa môže pohybovať v troch smeroch priestoru, preto je energia n mólov plynu:
Množstvo tepla
Za predpokladu, že sa do systému pridáva teplo a toto nefunguje, toto teplo sa používa iba pri zvyšovaní vnútornej energie systému. Množstvo tepla, ktoré musí byť úmerné hmotnosti M v systéme a zmenou teploty:
Q ∝ m kedy
Konštanta proporcionality závisí od látky a nazýva sa špecifické teplo. Volá C na túto konštantu, teplo je:
Q = mc⋅5t
Pretože teplo sa zvráti pri zvyšujúcej sa vnútornej energii:
Q = mc⋅5t = ΔU
ΔU zodpovedá variácia Vo vnútornej energii.
Príklady vnútornej energie
1. Teplotné variácie
Zmeny teploty látok zase vytvárajú zmeny vo svojej vnútornej energii. To sa stane napríklad pri varení. Zahrievaním potravín sa zvyšuje miešanie jeho molekúl, kinetická energia sa zvyšuje, a preto robí svoju vnútornú energiu.
2. Vnútorná energia dvoch látok pri rovnakej teplote
Dve látky pri rovnakej teplote nemusia mať nevyhnutne rovnakú vnútornú energiu, pretože závisí od dvoch príspevkov: kinetická energia a potenciálna energia.
Ak sú látky pri rovnakej teplote, možno potvrdiť, že translačná kinetická energia jeho častíc je rovnaká, ale potenciálna energia je iná, pretože to závisí od konfigurácie atómov zložiek.
Môže vám slúžiť: hydrostatický tlak: vzorec, výpočet, príklady, cvičenia3. Tepelná rozťažnosť
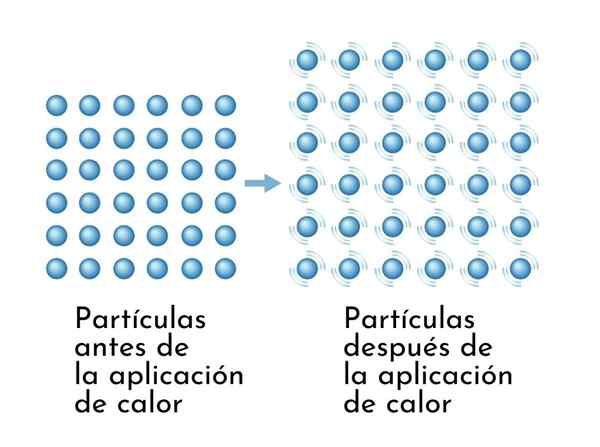 Látky sa pri zahrievaní rozširujú, pretože zvýšenie vnútornej energie spôsobuje, že ich častice sa širšie vibrujú, takže rozmery sa zvyšujú
Látky sa pri zahrievaní rozširujú, pretože zvýšenie vnútornej energie spôsobuje, že ich častice sa širšie vibrujú, takže rozmery sa zvyšujú Viditeľným dôsledkom vykurovacích látok je zvýšenie ich rozmerov, pretože priemerná vzdialenosť medzi jeho atómami sa zvyšuje.
Intermolekulárne sily môžu byť simulované pružinami, ktoré spájajú atóm.
4. Stlačené plyny
Komprimované plyny môžu ukladať vnútornú energiu, pretože ich hustota sa zvyšuje znížením objemu as ňou jeho interakcie so stenami nádoby na nádobu. Týmto spôsobom je stlačený plyn schopný vykonávať prácu, napríklad presun piest.
5. Batérie
Pri batérii sa vyskytujú chemické reakcie schopné generovať elektrický prúd hneď po zatvorení obvodu. Táto energia chemického potenciálu sa považuje za súčasť vnútornej energie systému.
6. Systém, ktorý absorbuje teplo a funguje
Keď systém absorbuje teplo, zvyšuje svoju vnútornú energiu. Ale ak zároveň vykoná prácu, prvý zákon termodynamiky sa dá použiť na to, aby vedel, koľko interných energetických zmien sa zmení. Napríklad za predpokladu, že systém absorbuje 175 j tepla a vykonáva prácu, ktorá je rovnajúca sa 62 J, zmena jeho vnútornej energie je:
ΔU = q - w = 175 j - 62 j = 113 j.



