Ionizačná energia

- 2726
- 535
- JUDr. Rudolf Čapkovič
Čo je ionizačná energia?
Ten ionizačná energia, Je to symbol I, je to minimálne množstvo energie potrebnej na spustenie vonkajšieho elektrónu na krtek atómov v plynnom stave, v jeho základnom stave. Inými slovami, je to minimálne množstvo energie potrebnej na transformáciu mol neutrálnych atómov do plynného stavu na mol iónov s pozitívnym zaťažením (odtiaľ jej názov).
Ionizačná energia by bola zrejmá vo forme chemickej rovnice energia potrebná pre nasledujúci proces:
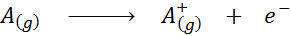
Ionizačná energia je priamym meradlom toho, ako silne sú vonkajšie elektróny chemického prvku spojené. Pri definovaní energie procesu ionizácie plynného stavu sa zabráni príspevku alebo interferencia intermolekulárnych interakcií, ktoré sa vyskytujú v kvapalných a tuhých stavoch.
Týmto spôsobom je zabezpečené, že ionizačná energia závisí iba od vnútorných síl atómu a najmä od stability elektrónov, ktoré tvoria valenčnú vrstvu každého prvku.
Proces odstraňovania elektrónu z vrstvy Valencie je proces, ktorý vyžaduje energiu, takže ide o endotermický proces. Z tohto dôvodu sú ionizačné energie vždy pozitívne (na základe konvencie, keď sa energia dostane do systému, považuje sa za pozitívnu).
Existuje viac ako jedna ionizačná energia
Aj keď sa definícia ionizačnej energie aplikuje na neutrálne atómy, ktoré sa stávajú pozitívnymi iónmi (tj katiónmi), môže sa tiež aplikovať na postupné odstránenie pozitívnych iónových elektrónov, tj druhov, ktoré už stratili elektróny.
V tomto zmysle sa energia na ionizáciu neutrálneho atómu stáva prvou z mnohých možných ionizačných energií, pretože pre každý elektrón, ktorý sa točí okolo jadra, je jedna.
Môže vám slúžiť: Aké sú prvky pohybu?Inými slovami, energie spojené so všetkými nasledujúcimi procesmi sa považujú za ionizačné energie:
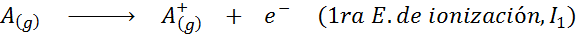
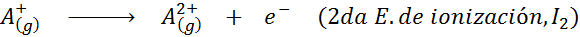
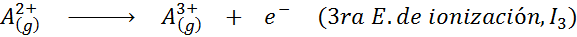
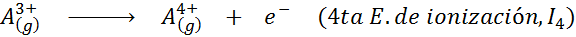
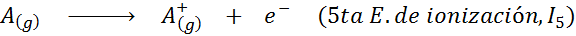
Poradie postupných ionizačných energií
Pre akýkoľvek atóm akéhokoľvek prvku je splnené, že ionizačná energia bude vždy väčšia ako všetky predchádzajúce ionizačné energie. Inými slovami, následné ionizačné energie majú nasledujúci vzťah:
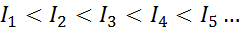
Dôvod, prečo sa to stane, je veľmi jednoduchý. Prvá ionizačná energia zahŕňa odstránenie elektrónu na neutrálny atóm. Druhá ionizačná energia však naznačuje, že elektrón na atóm, ktorý už stratil prvý.
Neprítomnosť elektrónu zanecháva pozitívne čisté zaťaženie, ktoré priťahuje zvyšné elektróny s väčšou silou, takže je ťažšie začať ich začať. Okrem toho táto neprítomnosť tiež znižuje účinok štítu, ktorý majú elektróny na najvzdialenejšie elektróny, takže ich jadro je schopné ich prilákať silnejšie.
Výsledkom je, že je ťažšie začať druhý elektrón ako prvý, a bude ťažšie začať tretí ako druhý, atď. tabuľkový periodický.
Z | Element | najprv | Druhý | Tretiny | Štvrťrok | Piaty | Šiesty |
1 | H | 1312 | |||||
2 | On | 2373 | 5251 | ||||
3 | Li | 520 | 7300 | 11815 | |||
4 | Byť | 899 | 1757 | 14850 | 21005 | ||
5 | B | 801 | 2430 | 3660 | 25000 | 32820 | |
6 | C | 1086 | 2350 | 4620 | 6220 | 38000 | 47261 |
7 | N | 1400 | 2860 | 4580 | 7500 | 9400 | 53000 |
8 | Ani | 1314 | 3390 | 5300 | 7470 | 11000 | 13000 |
9 | F | 1680 | 3370 | 6050 | 8400 | 11000 | 15200 |
10 | Nekóda | 2080 | 3950 | 6120 | 9370 | 12200 | 15000 |
Periodický trend ionizačnej energie
Ionizačná energia je periodická vlastnosť, ktorá sa zvyšuje zľava doprava a zdola na periodickú tabuľku, ako je vidieť v nasledujúcej grafike.
Môže vám slúžiť: lineárna dilatácia: čo je to, vzor a koeficienty, príklad
Variácia i za obdobie
Keď sa pohybujeme po dobu zľava doprava, trochu sa nazýva účinné jadrové zaťaženie, čo nie je nič iné ako skutočné kladné zaťaženie, ktoré môžu najviac vonkajšie elektróny „vidieť“ kvôli štítu najviac vnútornejších elektrónov.
To znamená, že sila, s akou je jadro schopné prilákať elektróny Valencie.
Variácia I v celej skupine
Keď zostupne v skupine, umiestňujeme elektróny do zvyšujúcich sa hladín energie, a preto na atómové orbitály čoraz viac ďaleko od jadra. Z tohto dôvodu sila, s ktorou jadro priťahuje valenčné elektróny, klesá, keď klesáme v skupine, a tiež znižuje ionizačnú energiu.
Ako určiť ionizačnú energiu?
Ionizačná energia je experimentálne určité množstvo prostredníctvom série techník nazývaných spolu fotoelektrónová spektroskopia.
Tieto techniky sú založené na fenoméne veľmi podobnom fotoelektrickému účinku, v ktorom je elektromagnetické žiarenie schopné začať elektróny atómu a rozdiel medzi energiou ožarovania a kinetickou energiou, s ktorou je elektrón prepustený.
Rôzne techniky fotoelektrónovej spektroskopie umožňujú analýzu energie, ktorých prakticky je akýkoľvek elektrón spojený s jeho jadrom, či už elektrón Valencie alebo vnútorný elektrón.
Príklady ionizačnej energie
Prvá ionizačná energia ušľachtilých plynov
Zvonené plyny majú najstabilnejšie elektronické konfigurácie všetkých prvkov periodickej tabuľky. Z tohto dôvodu majú tiež najväčšiu ionizačnú energiu. Prvá ionizačná energia každého z ušľachtilých plynov je uvedená nižšie:
-
Hélium
Jeho prvá ionizačná energia je 2373 kJ/mol, najvyššia v celej periodickej tabuľke.
-
Neón
Jeho prvá ionizačná energia je 2080 kJ/mol a je druhým najvyšším.
-
Argón
Jeho prvá ionizačná energia je 1521 kJ/mol. Iba f, ne a on má väčšie ionizačné energie.
-
Kripton
Prvá ionizačná energia je 1350 kJ/mol. Nie je to také vysoké ako ostatné, ale je stále väčší ako v prípade jej susedných prvkov.
-
Xenón
To isté, čo sa hovorí o Kriptone, možno povedať o xenóne s prvou ionizačnou energiou 1170 kJ/mol.
Môže vám slúžiť: Červohra: História, teória, typy, formovaniePrvá a druhá ionizačná energia alkalických kovov
Alkalické kovy majú zase najmenšiu prvú ionizačnú energiu a najväčšiu druhú ionizačnú energiu všetkých prvkov:
-
Lítium
Jeho prvá ionizačná energia je menej ako štvrtina energie, ale lítia má najväčšiu druhú ionizačnú energiu všetkých prvkov, čo je 7300 kJ/mol.
-
Sodík
Sodík stráca svoj prvý elektrón veľmi ľahko, pretože získava elektronickú konfiguráciu NE, ale na odstránenie druhého elektrónu musíte naplniť 4560 kJ/mol.
-
Draslík
Prvá energia ionizácie draselného je iba 418,7 kJ/mol, zatiaľ čo druhá je 3052 kJ/mol, podstatne väčšia ako energia jej susedov.
-
Rubídium
S ionizačnou energiou 403 kJ/mol je Rubidio jedným z prvkov s menšou ionizačnou energiou. Druhý je však 2633 kJ/mol.
-
Cézium
Jeho prvá ionizačná energia je iba 375 kJ/mol a druhá 2234 kJ/mol, dokonca nižšia ako prvá ionizačná energia hélia.

