Vnútorné elektróny
- 2773
- 229
- Adrián Fajnor
Vysvetľujeme, aké vnútorné elektróny sú, ich charakteristiky a uvádzame niekoľko príkladov
Čo sú vnútorné elektróny?
Kedykoľvek uvažujeme o atóme, predstavujeme si jadro tvorené protónmi a neutrónmi, obklopenými elektrónmi, ktoré sa okolo neho otáčajú, podobne ako sa planéty točia okolo slnka.
Ale nie všetky elektróny sú rovnaké a dve triedy sa dajú rozlíšiť, v závislosti od toho, ako blízko alebo ďaleko sú od atómového jadra.
Niektoré sú ďalej od jadra a nazývajú sa elektróny Valencia. Sú zodpovedné za všetky chemické reakcie, ktoré poznáme. Na druhej strane, Tí, ktorí sú najbližšie k jadru a sú s ním silnejšie, sú tí, ktorých nazývame vnútorné elektróny.
Charakteristiky vnútorných elektrónov
Sú najstabilnejšími elektrónmi
Spravidla, čím nižšia je hladina energie elektrónu, je to stabilnejšie. Interné elektróny zaberajú orbitály na najnižšej úrovni energie atómu, preto sú tiež najstabilnejšími elektrónmi.
Sú silnejšie zjednotení s jadrom
Jadro priťahuje elektróny, pretože obidve majú opačné zaťaženie: jadro je pozitívne, zatiaľ čo negatívne elektróny. Táto sila sa zvyšuje so znižovaním vzdialenosti.
V dôsledku toho sú vnútorné elektróny, ktoré sú najbližšie k jadru, tie, ktoré sú najsilnejšie spojené s rovnakým. Z toho istého dôvodu sú tiež najťažším odstránením elektrónov.
Nie sú súčasťou chemických väzieb
Keď sa jeden atóm priblíži k druhému, prvá vec, ktorú sa dotkne, je ich vonkajšie elektróny. Z tohto dôvodu zasahujú iba valencia elektróny v chemických reakciách. Interné elektróny ani sa nezúčastňujú na chemických väzbách, ani sa nezúčastňujú žiadnej chemickej reakcie.
Môže vám slúžiť: Koľko elektrónov s pudingom má uhlík?Sú veľmi tienisti
To znamená, že interné elektróny stoja medzi vonkajšími elektrónmi a jadrom, čím vytvára druh obrazovky, ktorá znižuje silu, s ktorou jadro priťahuje elektróny valencie.
Vždy prichádzajú do párov
V každom orbitáli sú iba dva elektróny s opačnými točeniami, ktoré sa nazývajú párové elektróny (čo je ďalší spôsob, ako povedať, že tvoria pár). Rovnako ako orbitály, v ktorých sa nachádzajú vnútorné elektróny, sú vždy úplne plné, takže tieto elektróny sú vždy spárované.
Ako vieme, koľko vnútorných elektrónov má atóm?
Vedieť, koľko vnútorných elektrónov má atóm, je veľmi jednoduché. Potrebujete len vedieť, koľko elektrónov má atóm a koľko z týchto elektrónov patrí do vrstvy Valencie. Všetky ostatné elektróny sú vnútorné elektróny.
Ale ako zistíme tieto čísla? V nasledujúcich častiach to vysvetlíme.
Celkový počet elektrónov sa rovná atómovému číslu
Pretože atómy sú neutrálne (to znamená, že nemajú čistý elektrický náboj), musia mať rovnaký počet kladných zaťažení (protónov) ako záporné zaťaženie (elektróny). Ako naznačuje atómové číslo.
V prípade iónov, ktoré na rozdiel od atómov majú elektrický náboj, sa celkový počet elektrónov získa odpočítaním atómového čísla s výnimkou iónového zaťaženia so všetkým a ich znamienkom.
Príklady
- Atóm uhlíka (C) je prvok číslo 6 periodickej tabuľky (to je jeho atómové číslo). Preto má atóm uhlíka celkom 6 elektrónov.
- Ión sodný (i) (NA+) má kladný náboj +1 a atómový počet sodíka je 11. Takže celkový počet elektrónov tohto iónu je: 11 - (+1) = 10 elektrónov.
- Ión chloridu (CL-) má záporné zaťaženie -1 a atómový počet chlóru je 17. Takže celkový počet elektrónov tohto iónu je: 17 - ( - 1) = 17 + 1 = 18 elektrónov.
Počet elektrónov Valencie sa rovná ich skupine v periodickej tabuľke
Prvky, ktoré patria do skupiny 1A (alkalické kovy), majú 1 elektrón Valencie. Tí, ktorí patria do druhého (alkaliner), majú 2, osoby 3. skupiny Boro, hliník, gallium atď.) Majú 3 a tak ďalej. To sa nevzťahuje na prechodné kovy.
Rovnako ako predtým, ióny sa odpočítajú od výpočtu svojich valenčných elektrónov.
Príklady
- Kyslík patrí do skupiny 6A pre to, čo má 6 valenčných elektrónov.
- Sulfidový ión (s2-) Patrí tiež do skupiny 6A, ale má zaťaženie -2, takže má: 6 -( -2) = 6 + 2 = 8 elektrónov Valencia.
Príklady rôznych atómov a ich vnútorných elektrónov
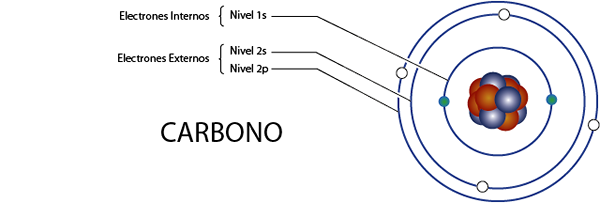
Vnútorné uhlíkové elektróny (C)

Ako sme videli pred chvíľou, uhlík má celkom 6 elektrónov. Okrem toho patrí do skupiny 4A pre to, čo má 4 elektróny vo Valencii, takže má celkom 6 - 4 = 2 vnútorné elektróny.
Elektróny vnútorného dusíka (N)
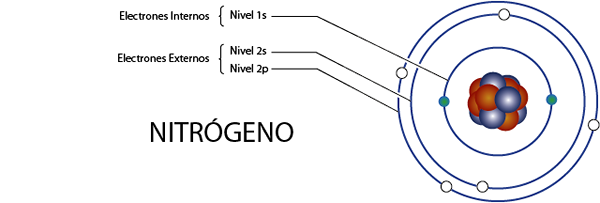
Dusík má celkom 7 elektrónov. Okrem toho patrí do skupiny 5A pre to, čo má 5 elektrónov vo Valencii, takže má celkom 7 - 5 = 2 vnútorné elektróny.
Interné elektróny argónu (AR)
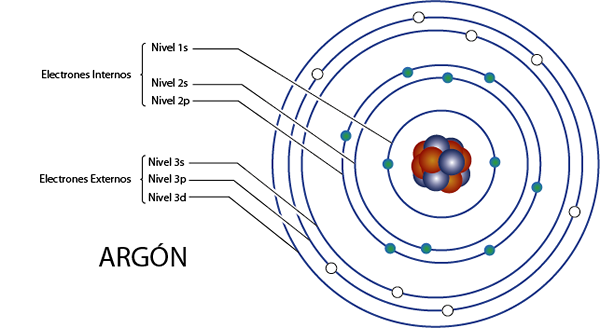
Argon je prvkom 18 pre to, čo má celkom 18 elektrónov. Okrem toho patrí do skupiny 8a pre to, čo má 8 elektrónov vo Valencii, takže má celkom 18 - 8 = 10 vnútorných elektrónov.
Vnútorné elektróny iónu chloridu (CL-)
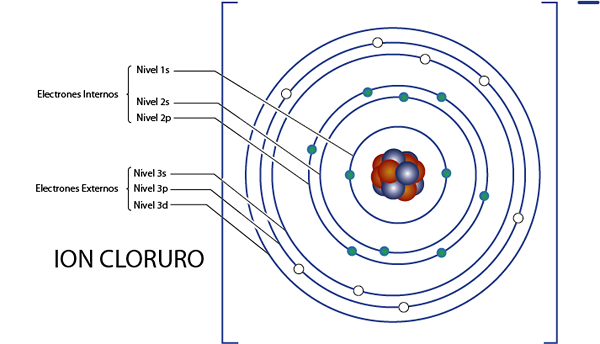
Ako sme videli pred chvíľou, chlorid má celkom 18 elektrónov. Okrem toho patrí do skupiny 7a a má zaťaženie -1, takže má 7 - ( - 1) = 8 elektrónov Valencia. Takže má 18 - 8 = 10 vnútorných elektrónov, Ako Argon.
Môže vám slúžiť: jadrová chémia: História, štúdium, oblasti, aplikácieInterné elektróny vápnika +2 iónov (CA2+)
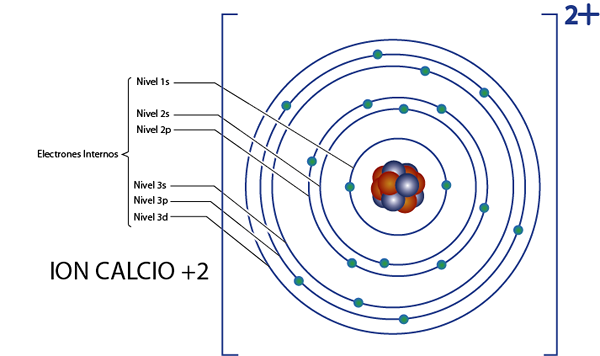
Vápnik je prvkom 20 a tento ión má 2 pozitívne náboje, takže má celkom 20 - 2 = 18 elektrónov okolo jadra. Tento prvok patrí do skupiny 2a a keďže je jeho zaťaženie +2, potom nemá valenčné elektróny (2 - 2 = 0). Z tohto dôvodu sú všetkých 18 elektrónov, ktoré zostali vápnikom, tie, ktoré boli pôvodne vnútornými elektrónmi.
Existujú dva prvky, ktoré nemajú vnútorné elektróny
Dva ľahšie prvky periodickej tabuľky, ktoré sú vodík (H) a hélium (HE), majú iba 1 a 2 elektróny. Oba elektróny sú na jedinej úrovni energie, ktorú majú tieto atómy, čo je úroveň 1.
Z tohto dôvodu tieto elektróny zodpovedajú valenčným elektrónom týchto dvoch prvkov. Pretože neexistujú nižšie úrovne energie, potom neexistujú žiadne vnútorné elektróny.

