Elektronegativita
- 1497
- 412
- Denis Škriniar
Čo je elektronegativita?
Ten Elektronegativita Je to relatívna periodická vlastnosť, ktorá sa týka schopnosti atómu prilákania elektronickej hustoty jeho molekulárneho prostredia. Toto je trend atómu na prilákanie elektrónov, keď je pripojený k molekule. To sa odráža v správaní mnohých zlúčenín a v tom, ako vzájomne interagujú.
Inými slovami, čím viac elektronegatívne je atóm, tým väčšia je schopnosť prilákať elektróny iných atómov; Bude mať tiež vyšší ionizačný potenciál, ktorý vám umožní udržiavať vaše elektróny tvárou v tvár vonkajšej príťažlivosti a zároveň priťahovať elektróny okolitých atómov.
Teraz nie všetky prvky priťahujú elektróny susedných atómov v rovnakej miere. V prípade tých, ktorí poskytujú elektronickú hustotu, sa hovorí, že sú elektropozitívny, Zatiaľ čo tí, ktorí „pokrývajú“ elektróny elektronegatín. Existuje mnoho spôsobov, ako vysvetliť a pozorovať túto vlastnosť (alebo koncept).
Napríklad v mapách elektrostatického potenciálu pre molekulu (ako je oxid chloričitého vynikajúceho obrazu, CLO2) Je pozorovaný účinok rôznych elektronegativitov na atómy chlóru a kyslíka.
Červená farba označuje oblasti bohaté na elektróny molekuly, δ- a modrá farba, ktorá je zlá z elektrónov, δ+. Po sérii výpočtových výpočtov je teda možné stanoviť tento typ máp; Mnohé z nich ukazujú priamy vzťah medzi umiestnením elektronegatívnych atómov a δ-.
Dá sa tiež vizualizovať takto: v molekule je pravdepodobnejšie, že tranzit elektrónov sa vyskytuje v blízkosti najviac elektronegatívnych atómov.
Z tohto dôvodu pre CLO2 Atómy kyslíka (červené gule) sú obklopené červeným oblakom, zatiaľ čo atóm chlóru (zelená guľa) modro.
Definícia elektronegativity závisí od prístupu daného k javu, existuje niekoľko stupníc, ktoré ju považujú za rôzne aspekty. Všetky stupnice však majú spoločné, že sú podporené vnútornou povahou atómov.
Elektronické stupnice
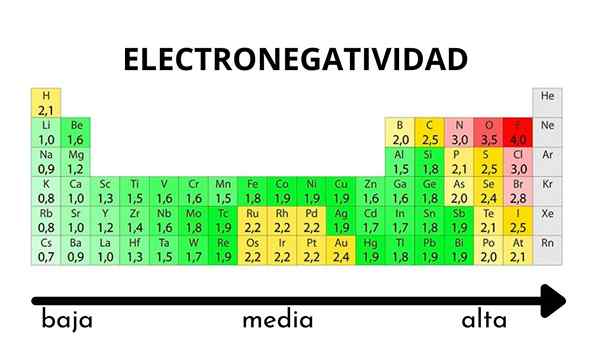
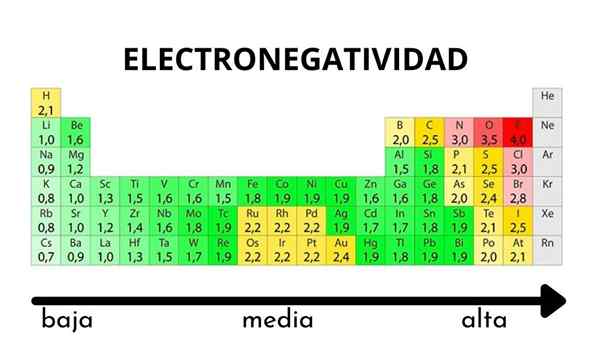 V periodickej tabuľke sa dá pozorovať, keď sa hodnota elektronegativity zvyšuje alebo klesá
V periodickej tabuľke sa dá pozorovať, keď sa hodnota elektronegativity zvyšuje alebo klesá Elektronegativita nie je vlastnosť, ktorú je možné kvantifikovať, ani nemá absolútne hodnoty. Je to preto, že trend atómu prilákania elektronickej hustoty voči nemu nie je rovnaký vo všetkých zlúčeninách. Inými slovami: Elektronegativita sa líši v závislosti od molekuly.
Ak pre molekulu CLO2 Atóm CL sa zmení na N, potom by sa zmenila aj tendencia alebo prilákanie elektrónov; Mohlo by sa to zvýšiť (Získajte oblak Redst) alebo znížiť (stratiť farbu). Rozdiel by spočíval v vytvorenom novom prepojení N-O, aby sa mala molekula O-N-O (oxid dusične, NO2).
Môže vám slúžiť: Vzťah chémie a technológie s človekom, zdravím a životným prostredímPretože elektronegativita atómu nie je rovnaká pre všetky jeho molekulárne prostredie, je potrebné ho definovať podľa iných premenných. Týmto spôsobom existujú hodnoty, ktoré slúžia ako referencia a ktoré umožňujú predpovedanie napríklad vytvoreného typu spojenia (iónové alebo kovalentné).
Pedári
Veľký vedec a víťaz Two Nobel Awards, Linus Pauling (1901-1994), v roku 1932 vyvýšil kvantitatívnu (merateľnú) formu elektronegativity, známa ako Paulingova stupnica. V ňom bola elektronegativita dvoch prvkov, A a B, formujúce spojenia, súvisiaca s ďalšou energiou spojenou s iónovým charakterom spojenia A-B.
Teoreticky sú kovalentné väzby najstabilnejšie, pretože rozdelenie ich elektrónov medzi dvoma atómami je spravodlivé; to znamená, že pre molekuly A-A a B-B oba atómy zdieľajú väzbové elektróny rovnakým spôsobom. Ak je však viac elektronegatívna, potom bude uvedený pár viac ako b.
V takom prípade už nie je A-B úplne kovalentný, hoci ak sa jeho elektronegativita príliš nelíši, dá sa povedať, že jeho prepojenie má vysoký kovalentný charakter. Ak k tomu dôjde, spojenie prechádza malá nestabilita a získava ďalšiu energiu ako produkt rozdielu elektronickejpativity medzi A a B.
Čím väčší je tento rozdiel, tým viac je energia spojenia A-B, a tým väčší iónový charakter uvedeného odkazu.
Táto stupnica predstavuje najpoužívanejšie v chémii a hodnoty elektronegativity sa objavili z pridelenia hodnoty 4 pre atóm fluóru (prvok s najnižšou elektronegativitou je Cessium, s 0,7). Odtiaľ mohli vypočítať to z ostatných prvkov.
Mullikenova stupnica
Zatiaľ čo Paulingova stupnica súvisí s energiou spojenou s odkazmi, stupnica Roberta Mulliken (1896-1986) viac súvisí s dvoma ďalšími periodickými vlastnosťami: ionizačná energia (EI) a elektronická afinita (AE).
Prvok s vysokými hodnotami EI a AE je teda veľmi elektronegatívny, a preto pritiahne elektróny z molekulárneho prostredia.
Pretože? Pretože odráža, aké ťažké je „spustiť“ vonkajší elektrón a ako stabilný anión tvorený v plynnej fáze je tak stabilný. Ak majú obe vlastnosti vysoké veľkosti, potom je prvkom „milenca“ elektrónov.
Môže vám slúžiť: fúziaMulliken Electronegativity sa počítajú s nasledujúcim vzorcom:
HrebeňM = ½ (ei + ae)
To znamená χM Sa rovná priemernej hodnote EI a AE.
Na rozdiel od stupnice Pauling, ktorá závisí od toho, v akom formulároch Atómov sa to týka vlastností stavu Valencie (s jeho najstabilnejšími elektronickými konfiguráciami).
Obe stupnice generujú podobné hodnoty elektronegativity pre prvky a súvisia približne s nasledujúcou konverziou:
HrebeňP = 1.35 (χM)1/2 - 1.37
Obidve xM ako xP Sú to bezrozmerné hodnoty; to znamená, že im chýbajú jednotky.
Stupnica a.L. Allred a E. Štrbina
Existujú aj iné stupnice elektronegativity, ako sú Sanderson a Allen. Ten, ktorý nasleduje po prvých dvoch, je však stupnica Allred a Rochow (χAr). Táto stupnica je založená na účinnom jadrovom zaťažení, ktoré elektrón prežíva na povrchu atómov. Preto priamo súvisí s atraktívnou silou jadra a efektom obrazovky.
Ako sa mení elektronická stanica v periodickej tabuľke?
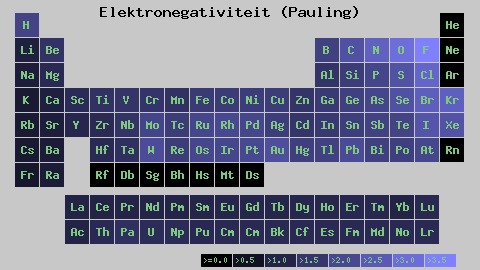 Stupnica s elektronickým elektrónkom. Zdroj: Wikimedia Commons
Stupnica s elektronickým elektrónkom. Zdroj: Wikimedia Commons Bez ohľadu na váhy alebo hodnoty, ktoré má, sa elektronická kocka zvyšuje sprava doľava na obdobie a zdola nahor v skupinách. Zvyšuje sa teda smerom k pravému hornému diagonálne (nepočítajúc hélium), kým nie je fluor.
Na vynikajúcom obraze, čerstvo povedané. V periodickej tabuľke sú Pauling Electronegativity vyjadrené podľa farieb škatule. Pretože fluorid je najviac elektronegatívny, je na ňom drsnejšia fialová farba, zatiaľ čo čím menej elektronegatívnych (alebo elektropozitívnych) farieb je tmavšie.
Je tiež vidieť, že skupinové hlavy (h, be, b, c atď.) Majú najjasnejšie farby a keďže skupina zostupuje ostatnými prvkami. O čom to je? Odpoveď je opäť v vlastnostiach EI, AE, ZEF (účinné jadrové zaťaženie) a na atómovom polomere.
Atóm v molekule
Jednotlivé atómy majú skutočný jadrový z a vonkajšie elektróny trpia účinným jadrovým zaťažením tieniaceho účinku.
Keď sa pohybuje v priebehu obdobia, ZEF sa zvyšuje tak, aby sa atóm uzavrel; to znamená, že atómové rádiá sa znižujú počas celého obdobia.
To má za následok, že v čase prepojenia jedného atómu s druhým budú elektróny „prúdiť“ do atómu s väčším ZEF. To tiež dáva iónovému charakteru odkazu, ak existuje výrazný trend elektrónov, aby sa dostal na atóm. Ak nie, hovorí sa o prevažne kovalentnom zväzku.
Môže vám slúžiť: fialové skloZ tohto dôvodu sa elektronegativita líši podľa atómových rádií, ZEF, ktoré zase úzko súvisia s EI a AE. Všetko je reťaz.
Užitočnosť elektronegativity
Elektronegativita v zásade slúži na určenie, či je binárna zlúčenina kovalentná alebo iónová. Keď je rozdiel elektronegativity veľmi vysoký (pri rýchlosti 1.7 alebo viac jednotiek) sa hovorí, že zlúčenina je iónová.
Je tiež užitočné rozoznať v štruktúre, ktorú regióny budú pravdepodobne bohatšie na elektróny.
Odtiaľ je možné predpovedať, ktorý mechanizmus alebo reakcia môže utrpieť zlúčeninu. V slabých oblastiach elektrónov, A+, je možné, že negatívne nabité druhy získané určitým spôsobom; A v oblastiach bohatých na elektróny môžu ich atómy interagovať veľmi špecifickými spôsobmi s inými molekulami (interakcie dipólov-dipolo).
Príklady (chlór, kyslík, sodík, fluorid)
Aké sú hodnoty elektronegativity pre atómy chlóru, kyslíka, sodíka a fluóru? Po fluoride, ktorý je najviac elektronegatívny? Použitím periodickej tabuľky sa pozoruje, že sodík má tmavo fialovú farbu, zatiaľ čo farby kyslíka a chlór sú vizuálne veľmi podobné.
Ich elektronické hodnoty pre stupnice Pauling, Mulliken a Allred-Rhow sú:
NA (0.93, 1.21, 1.01).
Alebo (3.44, 3.22, 3.päťdesiat).
Cl (3.16, 3.54, 2.83).
F (3.98, 4.43, 4.10).
Všimnite si, že s numerickými hodnotami je rozdiel medzi negativitami kyslíka a chlóru.
Podľa Mullikenovho stupnice je chlór viac elektronegatívny ako kyslík, na rozdiel od váhy Pauling a Allred-Rhowow. Rozdiel v elektronegativite medzi oboma prvkami je ešte zrejmejší pomocou stupnice Allred-Rhow. A nakoniec, fluorid, bez ohľadu na zvolenú stupnicu, je najviac elektronegatívny.
Preto tam, kde je atóm F v molekule, znamená, že spojenie bude mať vysoký iónový charakter.
Odkazy
- Triasť a Atkins. (2008). Anorganická chémia. (Štvrté vydanie., p. 30 a 44). MC Graw Hill.
- Jim Clark. (2000). ElektroneGivity. Zobraté z: Chemguide.co.Uk
- Anne Marie HelMestine, pH.D. (11. decembra 2017). Definícia a príklad elektronickej. Prevzaté: Thoughtco.com
- Značka e. Klenot. (5. novembra 2011). Elektronická stupnica. Prevzaté z: NYU.Edu
- Wikipedia (2018). Elektronegativita. Prevzaté: Je to.Wikipedia.orgán

