Slabý koncept elektrolytov, charakteristiky, príklady
- 4691
- 584
- Alan Milota
A Slabý elektrolyt Je to všetko, že látka sa rozpúšťa vo vode, nie je úplne ionizovaná. To znamená, že jeho rozpustenie produkuje alebo uvoľňuje nižšie množstvo iónov, ako by sa dalo očakávať. Tento ionizačný proces je stanovený pomocou rovnováhy hydrolýzy, v ktorej sa tvoria ióny ako H3Ani+ alebo oh-.
Slabé elektrolyty sú zvyčajne kovalentné zlúčeniny, ktorých molekuly majú tendenciu zostať neutrálne bez získania iónového zaťaženia. Mnohé z týchto elektrolytov pozostávajú z organických molekúl s ionizovateľnými funkčnými skupinami, hoci existujú aj anorganické typy vrátane niekoľkých oxacidiel.

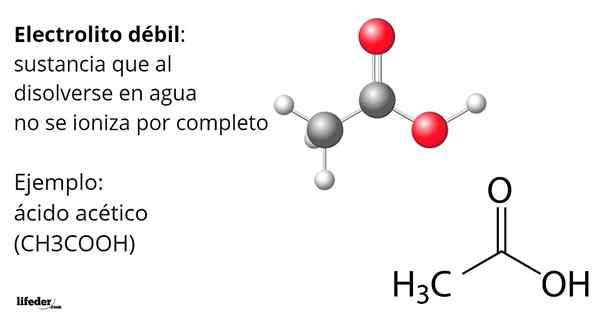
Kyselina octová, Cho3Cooh, je príkladom slabého elektrolytu. Jeho molekula má funkčnú skupinu, ktorá charakterizuje jej kyslosť vo vode. Ak však nie sú všetky jeho molekuly rozpustené, produkujú H ióny3Ani+ Transformácia v acetátovom aninii, Cho3Coo-, ale zostávajú neutrálne, protonované.
Niektoré elektrolyty sú slabšie ako iné, čo bude závisieť od stupňa ich ionizácie. Keď sa rozpustia, spôsobujú mierne zmeny v pH. Máme teda kyslé alebo základné slabé elektrolyty.
[TOC]
Charakteristiky slabých elektolitov
Sú to kovalentné zlúčeniny
Slabé elektrolyty sú vo všeobecnosti kovalentné zlúčeniny, takže ich zložkové jednotky sú molekuly.
Trpia hydrolýzou
Tieto molekuly majú schopnosť získať iónové zaťaženie. Za týmto účelom sa zúčastnite na hydrolýznej rovnováhe, v ktorej je molekula vody „časťou“ v OH-, alebo prijmite vodík na transformáciu na H3Ani+.
Čím menej pravdepodobná alebo nestabilná je hydrolýza, tým nižšie je množstvo alebo koncentrácie iónov prítomných v rozpustení týchto elektrolytov.
Majú nízku vodivosť
Roztoky slabých elektrolytov nie sú také dobré vodiče elektriny v porovnaní s roztokmi silných elektrolytov. Je to presne kvôli jeho najnižšiemu počtu iónov v roztoku, čo sťažuje prejsť elektrónmi vodou.
Môže vám slúžiť: manganická alebo kyselina permanganováPríklady slabých elektrolytov
 Kyselina octová z jablkového octu je najreprezentatívnejším príkladom slabého elektrolytu. Zdroj: pxhere.
Kyselina octová z jablkového octu je najreprezentatívnejším príkladom slabého elektrolytu. Zdroj: pxhere. Kyselina uhličitá
Molekula kyseliny uhličitám, h2Co3, Pri rozpustení vo vode trpí nasledujúca hydrolytická reakcia:
H2Co3 + H2Alebo ⇌ HCO3- + H3Ani+
Problém je v tom, že nie všetky h2Co3 Je ionizovaný v HCO3-. Okrem toho h2Co3 Neúmerne sa stal oxidom uhličitým a vodou, čo ďalej znižuje vodivosť tohto roztoku.
V prípade zostávajúcich príkladov bude táto skutočnosť recidy: molekula, ktorá je v zásade neutrálna, získa iónové zaťaženie a v procese sprostredkovanom hydrolýzou existujú ióny H3Ani+ alebo oh-.
AmonJoAc
Molekula amoniaku, NH3, Pri rozpustení vo vode trpí nasledujúca hydrolytická reakcia:
NH3 + H2Alebo ⇌ nh4+ + Oh-
Tieto amoniaálne roztoky vystrelia ostrú vôňu.
Tentokrát máme OH ióny-. Amoniak je slabá základňa, zatiaľ čo kyselina uhličitá, slabá kyselina. Preto sú kyseliny a slabé základy klasifikované ako slabé elektrolyty, pretože sú čiastočne ionizované bez uvoľnenia vysokých koncentrácií honov h3Ani+ alebo oh-, respektíve.
DoKyselinaanibohatý
Kyselina fosforečná, h3Po4, Je to príklad slabej oxoacidy, ktorá je zase elektrolyt:
H3Po4+ H2Alebo ⇌ h2Po4- + H3Ani+
Kyselina fosforečná je stále schopná utrpieť ďalšie dve disociácie, jedna pre každý kyslý vodík (celkom tri). Koncentrácia H3Ani+ Produkovaný je menší v porovnaní so silnou oxoacidou, ako je kyselina dusičná, HNO3, čo je silný elektrolyt. Čím slabší je elektrolyt, tým menej kyslý alebo základný bude.
HydroaniGeno
Fluorid vodíka, HF, je príkladom anorganickej kovalentnej zlúčeniny, ktorá bez toho, aby bola oxoacidou, je slabý elektrolyt, pretože je to slabá kyselina. Pri rozpustení vo vode sa produkuje kyselina fluórska, ktorá je čiastočne ionizovaná:
Môže vám slúžiť: kobaltový hydroxidHF+ H2Alebo ⇌ f- + H3Ani+
Napriek tomu, že nie je silným elektrolytom, kyselina fluoridová je schopná „jesť“ pohár materiálov, ktoré sa bežne používajú na skladovanie kyslých roztokov.
Pyridín
Pyridín, c5H5N, je amín, ktorý je hydrolyzovaný na vytvorenie iónov OH-:
C5H5N + h2Alebo ⇌ c5H5NH + + Oh-
Pyridín je základnejší ako amoniak, takže jeho ionizácia bude väčšia, a preto bude produkovať väčšie koncentrácie OH iónov-.
DoKyselinaJoDrico
Kyselina cyanhydrová, HCN, je tiež ďalším príkladom slabej kyseliny a elektrolytu:
HCN + H2Alebo ⇌ cn- + H3Ani+
Nerozpustné soli
Tento bod je kontroverzný. Doteraz boli slabé elektrolyty klasifikované ako slabé kyseliny alebo bázy, ktoré sa vyznačujú ich čiastočnými ionizáciami. Nerozpustné soli vo vode, ktoré sú už vo svojich kryštáloch ionizované, sa však tiež považujú za slabé elektrolyty.
Pri rozpustení s ťažkosťami vo vode je množstvo iónov, ktoré sa uvoľňujú v roztoku, malé v porovnaní s množstvom rozpustných solí. V tomto zmysle nerozpustné soli produkujú menej vodivé roztoky, ktoré ich trochu zatienia ako silné elektrolyty.
Z tohto dôvodu sa predpokladá, že tieto soli patria do skupiny slabých elektrolytov, aj keď rozpúšťanie vytvárajú neutrálne ióny a neutrálne molekuly s ionizačnými stupňami.
Chlorid striebra
Chlorid strieborného, AGCL, rozpúšťa sa vo vode, čím sa produkujú ióny AG AG+ a cl-. Je to však celkom nerozpustná soľ. Množstvo uvoľňovaných iónov je omnoho nižšie, ako by to bolo, keby bolo úplne rozpustné, rovnako ako v prípade dusičnanu striebra, Agno3, Silný elektrolyt.
Môže vám slúžiť: rozptýlená fázaUhličitan vápenatý
Uhličitan vápenatý, Caco3, Je to nerozpustná soľ, ktorá rozpustením čiastočne vytvára ióny CA2+ a co32-. Táto soľ, na rozdiel od AGCL, je základná, pretože CO32- je hydrolyzovaný na generovanie iónov oh-.
Sulfát zinku
Sulfát zinku, zonso4, Čiastočne sa rozpustí vo vode na výrobu iónov Zn2+ A tak42-.
Fluorid vápenatý
Fluorid vápnika, CAF2, Prirodzene sa nachádza ako fluoritový minerál, rozpúšťa sa práve vo vode, aby produkoval ióny CA2+ a f-.
Oxid horečnatého
Oxid horečnatý, MGO, je pomerne nerozpustná iónová zlúčenina vo vode. Malá časť, ktorá sa rozpúšťa, reaguje na transformáciu na zodpovedajúci hydroxid, mg (OH)2, čo je skutočný zodpovedný za vzhľad iónov MG2+ a oh-.
Preto MGO, napriek tomu, že je iónový, nemožno klasifikovať ako silný elektrolyt, pretože vo vode neuvoľňuje ióny svojich vlastných kryštálov (mg2+ I2-).
Odkazy
- Whitten, Davis, Peck & Stanley. (2008). Chémia. (8. vydanie.). Učenie sa.
- Triasť a Atkins. (2008). Anorganická chémia. (Štvrté vydanie). MC Graw Hill.
- Chung & Chieh. (5. júna 2019). Elektrolyty. Chémia librettexts. Získané z: Chem.Librettexts.orgán
- Helmestín, Todd. (11. februára 2020). Slabá definícia a príklad elektrolytu. Zotavené z: Thoughtco.com
- Danielle Reid. (2020). Slabý elektrolyt: Definícia a príklad. Štúdium. Získané z: štúdie.com
- « Girondinos pozadie, kto ste vy a vodcovia
- Charakteristiky šikmé trojuholníky, príklady, cvičenia »

