Referenčné charakteristiky elektród, funkcie, príklady
- 5080
- 623
- Adrián Fajnor
On referenčná elektróda Je to zariadenie, ktoré sa používa pri potenciometrickej a voltamétrickej analýze na kvantitatívne stanovenie analytu. Jeho dôležitosť je, ako už názov napovedá, slúžiť ako odkaz na odhad skutočnej hodnoty potenciálu v reakcii elektrochemického polo -elku.
Potenciály polotydia závisia od koncentrácie záujmu iónu, pretože reaguje víťazstvom alebo stratou elektrónov. Týmto spôsobom je možné určiť ich koncentráciu prostredníctvom týchto potenciálov. Ich hodnoty však nie sú absolútne, ale súvisia so štandardnou vodíkovou elektródou (ona v angličtine).
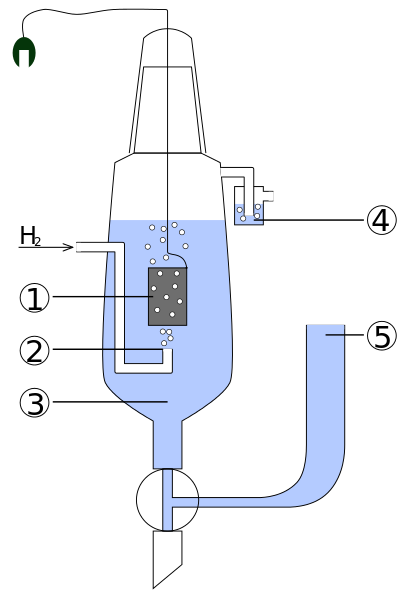
 Schéma častí štandardného vodíka. Zdroj: štandard_hydrogen_electrode.JPG: KaverinderVivevatívne dielo: Henry Muelpfordt/CC By-S (http: // creativeCommons.Org/licencie/By-SA/3.0/)
Schéma častí štandardného vodíka. Zdroj: štandard_hydrogen_electrode.JPG: KaverinderVivevatívne dielo: Henry Muelpfordt/CC By-S (http: // creativeCommons.Org/licencie/By-SA/3.0/) Na základe dohovoru sa potenciály vodíkových elektród rovnajú 0V. Problém je v tom, že tieto elektródy sa ťažko manipuluje, takže ich nie je praktické inštalovať ich vo všetkých analýzach. Tu vstupujú referenčné elektródy, oveľa jednoduchšie a ktorých potenciál sa líši od 0V.
Niektoré z referenčných elektród, ako napríklad Calomelova nasýtená elektróda (ESC), môžu byť postavené v rovnakom laboratóriu pred vykonaním analýzy. Podobne sa na trhu otvorene získavajú so svojimi správnymi špecifikáciami a riziká kontaminácie vzorky analytu sú minimálne.
[TOC]
Charakteristiky referenčnej elektródy
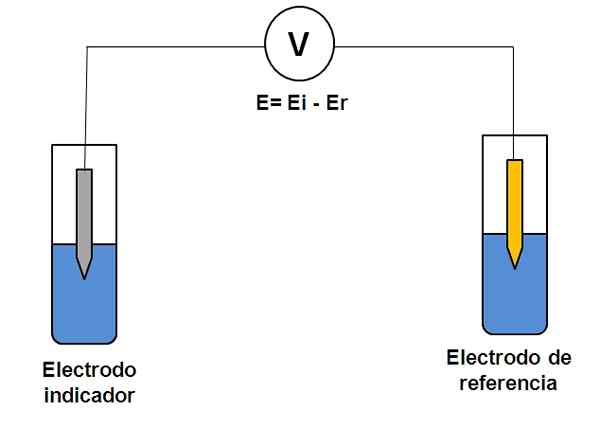 Jednoduché znázornenie dvoch elektródových systémov v potenciometrii. Zdroj: Gabriel Bolívar.
Jednoduché znázornenie dvoch elektródových systémov v potenciometrii. Zdroj: Gabriel Bolívar. Zvážte dva elektródy vyššie. Jedným z nich je ukazovateľ (šedý), kde dôjde k záujmovej reakcii a druhým je referencia (zlato). Táto elektrochémia bude mať potenciál a ktorá sa bude rovnať rozdielu potenciálov oboch elektród (EI-E). Preto každá variácia v E musí byť spôsobená potenciálom indikátorovej elektródy.
Môže vám slúžiť: Kyanid draselný (KCN): Vlastnosti, použitia, štruktúry, riziká,Z vyššie uvedeného sa dospelo k záveru, že referenčná elektróda má nasledujúce charakteristiky:
-Má v priebehu času stabilný potenciál a je reprodukovateľný. To znamená, že by to malo byť rovnaké bez ohľadu na to, kde alebo koľkokrát sa merania vykonávajú.
-Jeho chemické zloženie je konštantné a necitlivé, takže ťažko prechádza zmenami, keď interaguje s roztokom analytu alebo sa ponoruje do vodného média.
-Na rozdiel od štandardnej vodíkovej elektródy, ktorá si vyžaduje používanie vodíkovej nádrže, je ľahké ho zostaviť a namontovať.
Indikátorová elektróda je taká, ktorá je citlivá na koncentráciu analytu.
Funkcia referenčnej elektródy
Potenciály referenčných elektród sa merajú oproti štandardnej vodíkovej elektróde, takže ich hodnoty sa líšia od 0V. Vďaka týmto vodíkovým elektródam je možná konštrukcia štandardných a štandardných potenciálových tabuliek, ktoré sa objavujú v chemických textoch pre redoxné reakcie symfíny.
V praxi však všade nenamíja vodíkovú elektródu. Namiesto toho sa používajú referenčné elektródy, oveľa jednoduchšie a bezpečne na manipuláciu.
Keďže jeho potenciály sú konštantné a stabilné, potenciálne hodnoty elektrochémie bunky sú výlučne spôsobené indikátorovou elektródou; to znamená, že variácie koncentrácie príslušného analytu.
Funkciou referenčnej elektródy je teda určiť potenciál akejkoľvek reakcie v jednom zo čiastočných obmedzení elektrochemického systému. Ak by ich potenciály neboli stabilné, potom by kvantitatívne stanovenia analytu neboli spoľahlivé. Akákoľvek potenciometrická alebo voltametrická analýza by mala špecifikovať, ktorú referenčnú elektródu použili na nahlásenie svojich výsledkov.
Môže vám slúžiť: kyselina bromous (HBRO2): fyzikálne a chemické vlastnosti a použitiaPríklady referenčných elektród
Na trhu je k dispozícii niekoľko referenčných elektród. Niektorí sa používajú na veľmi špecifické stanovenia. Medzi všetkými z nich sú však dve elektródy, ktoré vynikajú vďaka svojej jednoduchosti a praktickosti: Calomel Electrode a strieborné strieborné-clloride, ktoré sa veľmi opakujú v mnohých potenciometrických a voltamletrických analýzach.
Elektróda
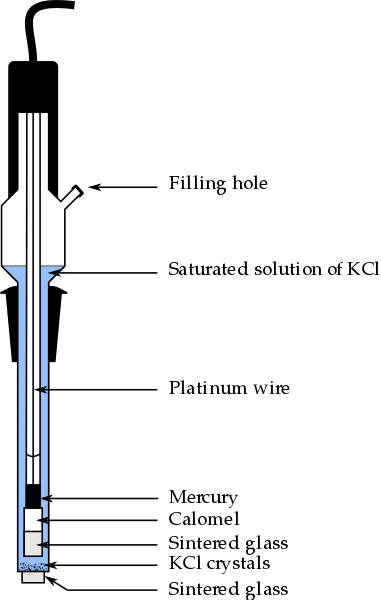 Časti kalomelovej elektródy, jednej z najpoužívanejších referenčných elektród v analytickej chémii. Zdroj: Bachi-Bouzouk Via Wikipedia.
Časti kalomelovej elektródy, jednej z najpoužívanejších referenčných elektród v analytickej chémii. Zdroj: Bachi-Bouzouk Via Wikipedia. Na hornom obrázku sú zobrazené konvenčné časti nasýtenej kalomelovej elektródy, ECS. Hovorí sa, že je nasýtený, pretože obsahuje nasýtený roztok KCL (modrá), ktorý tiež predstavuje odvrátene KCL.
Vnútorný stĺpec, ktorý prešiel platinovým drôtom, je naplnený ortuťou, ktorý zase kontaktuje Calomel Paste, Hg2Cl2 o Chlorid ortuti (I) a nasýtený roztok KCl. V tejto elektróde je teda dôležitá koncentrácia CL iónov-, Pretože jej hodnota modifikuje potenciál elektródy.
Reakcia, ktorá sa odohráva, je nasledujúca:
Hg2Cl2(s) + 2e- ⇌ 2hg (l) + 2cl-
A má EST 0.241 V.
Na dolnom konci ECS je pórovité vyprážanie, ktoré sa vkladá do elektrického kontaktu s roztokom analytu a umožňuje kontrolovanú výmenu iónových iónov-. Inak by došlo k kontaminácii chloridov vo vzorke a tiež by elektróda stratila svoj vzácny nasýtený roztok KCL.
Táto elektróda sa používa na merania pH a všeobecne na akomkoľvek analyte, ktorého koncentráciu je možné určiť vo vodnom médiu.
Môže vám slúžiť: tepelný alkohol: štruktúra, vlastnosti, riziká a použitieStrieborná elektróda
 Striebro. Zdroj: Tenofalltrades (talk) (nahrávanie). / Verejná doména
Striebro. Zdroj: Tenofalltrades (talk) (nahrávanie). / Verejná doména Podobne ako Calomelova elektróda, strieborná strieborná elektróda pozostáva zo strieborného drôtu pokrytého strieborným chloridom a tiež ponorená do roztoku nasýteného zmesou KCL a AGCL.
Všetky jej časti sú chránené v plastovej trubici, ktorá má pórovitý otvor, cez ktorý vytvára elektrický kontakt s roztokom.
Reakcia, ktorá definuje jeho potenciál, EST = 0.197 V, je nasledovne:
AGCL (s) + e- ⇌ AG (S)+CL-
Táto elektróda predstavuje väčšie využitie a preferencie ako v prípade Calomel, čo je spôsobené negatívnym vplyvom ortuti na životné prostredie. Na druhej strane, strieborné strieborné elektródy sú jednoduchšie, bezpečné a lacné v laboratóriu.
Potom hovoríme, že elektróda striebornej danej nahrádza Calomel v mnohých jeho aplikáciách (potenciometrické stupne, testy korózie, elektrochemická analýza atď.).
Je to tiež jedna z preferovaných možností v biológii a medicíne, najmä v oblasti elektrokardiografie a elektroencefalografie, pretože striebro alebo ich soľ sú relatívne toxickými látkami pre telo.
Odkazy
- Deň, r., & Underwood, a. (1965). Kvantitatívna analytická chémia. (Piate ED.). Pearson Prentice Hall.
- Džbán.Do., Západný D.M. (1986). Inštrumentálna analýza. (Druhé vydanie.). Medziprítomský., Mexiko.
- Wikipedia. (2020). Referencia. Zdroj: In.Wikipedia.orgán
- Elsevier B.Vložka. (2020). Referencia. Vedecký. Zdroj: ScienceDirect.com
- Chémia librettexts. (9. júna 2020). Referenčné elektródy. Získané z: Chem.Librettexts.orgán
- « Lighthouse Lighthouse Lighthouse, história, popis, zrúcaniny
- Biografia Emily Dickinson, úspechy, diela, frázy »

