Časti a príklady chemickej rovnice
- 3755
- 492
- Alan Milota
Ten Chemická rovnica Je to schematické znázornenie niektorých charakteristík chemickej reakcie. Dá sa tiež povedať, že chemická rovnica opisuje zmeny, ktoré sa vyskytujú rôznymi látkami zapojenými do reakcie.
V chemickej rovnici sú umiestnené vzorce a symboly rôznych zúčastnených látok, ktoré jasne poukazujú na počet atómov každého prvku prítomných v zlúčeninách, ktoré sa javia ako index a nedá sa zmeniť pri vyrovnávaní rovnice.
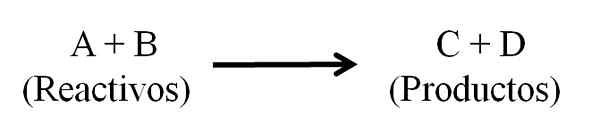
 Všeobecná chemická rovnica pre chemickú reakciu. Reagencie a výrobky. Zdroj: Gabriel Bolívar.
Všeobecná chemická rovnica pre chemickú reakciu. Reagencie a výrobky. Zdroj: Gabriel Bolívar. Chemická rovnica sa musí javiť ako vyvážená, to znamená, že počet atómov reagencií a výrobkov musí byť rovnaký. Týmto spôsobom sa dodržiava zákon o zachovaní hmoty. Je žiaduce, aby čísla použité na vyváženie rovníc sú celé čísla.
Tieto rovnice neodhaľujú po sebe nasledujúce kroky alebo prečo sa činidlá mechanizmov transformujú na výrobky.
Preto sú veľmi užitočné pochopiť, kam chemická reakcia prebieha, neumožňuje porozumieť jej molekulárnym aspektom alebo ako sú ovplyvnené určitými premennými; ako je pH, viskozita, reakčný čas, rýchlosť agitácie,.
[TOC]
Časti chemickej rovnice
V podstate existujú tri hlavné časti v chemickej rovnici: reagencie, produkty a šípka, ktorá označuje význam chemickej reakcie.
Umiestnenie činidiel a výrobkov
V chemickej rovnici všetky látky, ktoré fungujú ako činidlá, a všetky výrobky sa objavujú. Tieto skupiny látok sú oddelené šípkou, ktorá naznačuje význam reakcie. Reagencie sú umiestnené vľavo od šípky a výrobky vpravo.
Šípka znamená, čo sa vyrába a je orientovaná zľava doprava (→), hoci v reverzibilných reakciách existujú dve ekvivalentné a paralelné šípky; jeden nasmerovaný doprava a druhý doľava. Symbol (δ) sa zvyčajne kladie na šípku, čo naznačuje, že v reakcii sa použilo teplo.
Môže vám slúžiť: terpenosOkrem toho sa identifikácia katalyzátora zvyčajne umiestni na šípku, ak je to možné so svojím vzorcom alebo symbolom. Rôzne látky, ktoré sa javia ako činidlá, sú oddelené znakom (+), čo naznačuje, že látky reagujú alebo navzájom kombinujú.
V prípade látok, ktoré sa javia ako výrobky, značka (+) nemá predchádzajúcu konotáciu; Pokiaľ nie je reakcia reverzibilná. Je vhodné, aby sa značka (+) umiestnila rovnocenne od látok, ktoré sa oddeľujú.
Rovnováha chemických rovníc
Je nevyhnutnou požiadavkou, aby boli chemické rovnice správne vyvážené. Z tohto. Vždy, keď je to potrebné, tento koeficient musí ísť pred látky, ktoré sa javia ako reagenty alebo výrobky.
Je to tak, aby sa zabezpečilo, že počet všetkých atómov prvkov, ktoré sa javia ako činidlá, sa presne rovná počtu z nich, ktorý sa objaví v produkte. Najjednoduchšia metóda chemických rovníc je metóda Tanteo.
Fyzikálne stavy komponentov chemickej rovnice
V niektorých chemických rovniciach je fyzikálny stav látok označený ako sub -odvetvia. Na tento účel sa v španielčine používajú nasledujúce skratky: (S) pre pevný stav; l) pre tekutý stav; g), plynný stav; a (ac), vodný roztok.
Príklad: Uhličitan vápenatý s kyselinou chlorovodíkovou.
Zlodej3 (s) + 2 HCl(Ac) → CACL2 (s) + H2Ani(L) + Co2 g)
Zmeny fyzického stavu
V niektorých prípadoch je uvedené v chemickej rovnici, ak došlo k produkcii plynu v chemickej reakcii alebo ak dôjde k zrážkam niektorých z produkovaných látok.
Môže vám slúžiť: binárne soliPrítomnosť plynu je označená vertikálnou šípkou s koncom nasmerovaným smerom nahor (↑), umiestnený na pravej strane plynnej látky.
Príklad: Reakcia zinku s kyselinou chlorovodíkovou.
Zn +2 HCl → ZnCl2 + H2↑
Ak v chemickej reakcii jedna z látok tvorí zrazeninu, je to symbolizované umiestnením vertikálnej šípky s jej koncom nasmerovaným nadol (↓), umiestnené na pravej strane vyzrážanej látky.
Príklad: Reakcia kyseliny chlorovodíkovej s dusičnanom striebra.
Hcl + Agno3 → Hno3 + AGCL ↓
Príklad chemických rovníc
- Fotosyntéza
 Fotosyntéza rovnice
Fotosyntéza rovnice Fotosyntéza je proces, ktorým rastliny zachytávajú a transformujú svetnú energiu zo slnečného žiarenia, aby sa vytvorila energia potrebná pre ich obživa. Fotosyntéza vykonáva organely typické pre rastlinné bunky nazývané chloroplasty.
V chloroplastovej membráne sú tilakoidy, miesta, kde sa nachádzajú chlorofyly do a b, ktoré sú hlavnými pigmentmi, ktoré zachytávajú svetelnú energiu.
Zatiaľ čo fotosyntéza je komplexný proces, môže byť schematizovaná v nasledujúcej chemickej rovnici:
6 co2 + 6 h2O → C6H12Ani6 + 6 o2↑ δgº = 2.870 kj/mol
C6H12Ani6 Je to vzorec glukózy, metabolizovaného uhľohydrátu na výrobu ATP; Zlúčenina, ktorá je hlavnou energetickou nádržou vo väčšine živých bytostí. Okrem toho sa vytvorí z glukózy NADPH, koenzým potrebný na početné reakcie.
- Bunkové dýchanie
Bunky používajú kyslík na metabolizmus mnohých látok prítomných v požitých potravinách. Medzitým sa ATP používa ako energetický zdroj činností vykonávaných živými bytosťami, ktoré produkujú v týchto procesoch uhličitý a voda oxidu oxidu.
Môže vám slúžiť: octaán z hliníka (AL (CH3COO) 3): Štruktúra, vlastnosti, použitiaAk sa glukóza používa ako model metabolizovanej látky, dýchanie sa môže schematizovať podľa nasledujúcej chemickej rovnice:
C6H12Ani6 + 6 o2 → 6 CO2 + 6 h2Ani
- Bežné reakcie prvkov
Reakcia rozkladu
Zlúčenina alebo zlúčeniny sa disociujú (N) tvoriacich s atómami Iné rôzne zlúčeniny:
2 kclo3 (s) → 2 kcl(S) + 3 o2 g)
Reakcia
Kov reaguje so zlúčeninou, ktorá v tomto nahradí kov:
Mg(S) + Cuso4 (ac) → Cu(S) + Mgso4 (ac)
Eliminačná reakcia
Pri tomto type reakcie počet atómov alebo skupín pripojených k atómu uhlíka:
Chvály3-Chvály2BR +NaOH → H2C = ch2 + H2O +NABR
Hydratačná reakcia
Je to reakcia, pri ktorej zlúčenina pridáva molekulu vody. Táto reakcia je dôležitá pri príprave alkoholov:
H2C = ch2 + H2O → h2C-C-CH2Oh
Neutralizačná reakcia
Základ alebo alkali reaguje s kyselinou produkujúcou soľ a vodu:
Hcl(Ac) + Naoh(Ac) → NaCl(Ac) + H2Ani(L)
Reakcia syntézy
V tomto type reakcie sa kombinujú dve alebo viac látok, aby spôsobili novú zlúčeninu:
2 Li(S) + Cl2 g) → 2 Licl(S)
Reakcia dvojitého posunu (metatéza)
V tomto type reakcie je výmena pozitívnych a negatívnych iónov za vznik nových zlúčenín:
Agno3 (ac) + NaCl(Ac) → AGCL(S) + Starší brat3 (ac)
Odkazy
- Kvety, J. (2002). Chémia. Vydanie 1bol. Redakcia Santillana
- Mathews, C. Klimatizovať., Van Holde, K. A., A Ahern, K. G. (2002). Biochémia. 3bol Vydanie. Pearson Addison Wesley Editorial
- Whitten, Davis, Peck & Stanley. (2008). Chémia. (8. vydanie.). Učenie sa.
- Wikipedia. (2019). Chemická rovnica. Zdroj: In.Wikipedia.orgán
- HelMestine, Anne Marie, PH.D. (20. september 2019). Čo je chemická rovnica? Zotavené z: Thoughtco.com
- « Koncept a vzorec molárneho objemu, výpočet a príklady
- Challenger Abyss Geological Formation, Umiestnenie, charakteristiky »

