Štruktúra oxidu siričitého (SO2), vlastnosti, použitia, riziká

- 3660
- 932
- Václav Višňovský
On oxid Je to plynná anorganická zlúčenina tvorená síry (S) a kyslík (O), čo je jej chemický vzorec2. Je to bezfarebný plyn s dráždivým a dusiacim zápachom. Okrem toho je to rozpustné vo vode, ktoré tvoria kyslé roztoky. Sopky ho počas erupcií vylúčili do atmosféry.
Je súčasťou biologického a geochemického cyklu síry, ale vytvára sa vo veľkých množstvách určitými ľudskými činnosťami, ako je rafinácia ropných a horiacich fosílnych palív (napríklad uhlie alebo nafta).
 Oxid sulfur tak2 Vydávajú sopky počas erupcií. Brocken Inaglory [CC By-S (https: // creativeCommons.Org/licencie/By-SA/3.0)]. Zdroj: Wikimedia Commons.
Oxid sulfur tak2 Vydávajú sopky počas erupcií. Brocken Inaglory [CC By-S (https: // creativeCommons.Org/licencie/By-SA/3.0)]. Zdroj: Wikimedia Commons. Tak2 Je to redukčné činidlo, ktoré umožňuje, aby papierová dužina zostala biela po praní špinavých peňazí s inými zlúčeninami. Slúži tiež na odstránenie zvyškov chlóru vo vode, ktorá bola ošetrená týmto chemikom.
Používa sa na udržanie niektorých druhov jedla, dezinfekcia nádob.
Používa sa tiež ako fungicíd v poľnohospodárstve, na získanie kyseliny sírovej, ako rozpúšťadlo a ako sprostredkovateľ v chemických reakciách.
Tak2 Prítomné v atmosfére je škodlivé pre mnoho rastlín, vo vode sa ryba ovplyvňuje a je tiež jedným z tých, ktorí sú zodpovední za „kyslý dážď“, ktorý koroduje materiály vytvorené ľudskou bytosťou.
[TOC]
Štruktúra
Molekula oxidu siričitého je symetrická a tvorí uhol. Uhol je ten, že SO2 Má niekoľko osamelých elektrónov, to znamená elektróny, ktoré sa spájajú s akýmkoľvek atómom, ale sú zadarmo.
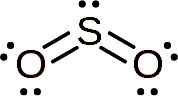 Lewisova štruktúra oxidu siričitého, kde sa pozoruje jeho uhlový tvar a pár voľných elektrónov. WhittleMario [CC By-SA (https: // creativeCommons.Org/licencie/By-SA/4.0)]. Zdroj: Wikimedia Commons.
Lewisova štruktúra oxidu siričitého, kde sa pozoruje jeho uhlový tvar a pár voľných elektrónov. WhittleMario [CC By-SA (https: // creativeCommons.Org/licencie/By-SA/4.0)]. Zdroj: Wikimedia Commons. Menovanie
- Oxid
- Anhydrid síry
- Oxid.
Vlastnosti
Fyzický stav
Bezfarebný plyn.
Molekulová hmotnosť
64,07 g/mol
Bod topenia
-75,5 ° C
Bod varu
-10,05 ° C
Hustota
Plyn: 2,26 až 0 ° C (vzhľadom na vzduch, to znamená hustota vzduchu = 1). To znamená, že je ťažší ako vzduch.
Kvapalina: 1,4 A -10 ° C (vzhľadom na vodu, to znamená hustota vody = 1).
Rozpustnosť
Vodné rozpustné: 17,7% pri 0 ° C; 11,9% pri 15 ° C; 8,5% pri 25 ° C; 6,4% pri 35 ° C.
Rozpustný v etanole, dityl éteru, acetóne a chloroforme. Je menej rozpustný v nepolárnych rozpúšťadlách.
pH
Vodné roztoky SOS2 Sú kyslé.
Chemické vlastnosti
Tak2 Je to silné redukčné a oxidačné činidlo. V prítomnosti vzduchu a katalyzátor oxiduje tak3.
SW2 + Ani2 → SO3
Dvojice osamelých elektrónov sa niekedy správajú ako základ Lewisa, inými slovami, môžu reagovať so zlúčeninami, kde je atóm, ktorý chýba elektrónmi.
Môže vám slúžiť: Železné podanie: vlastnosti, ako sa vyrábajú, toxicita, použitieAk áno2 Je vo forme plynu a sucha neútočí železo, oceľ, zliatiny medi-nickelu alebo nikel-chróm-hydro. Ak je však v tekutine alebo vlhkom stave, vytvára koróziu k týmto kovom.
Tak2 Kvapalina s 0,2% vody alebo viac produkuje silnú koróziu železa, mosadze a medi. Je to korozívne pre hliník.
Ak je to tekutina, môžete tiež zaútočiť na niektoré plasty, gumy a povlaky.
Vodné SOS2
Tak2 Je veľmi rozpustný vo vode. Dlho sa uvažovalo o tom, že vo vode kyselina síra sa formuje h2SW3, Ale existencia tejto kyseliny nebola preukázaná.
V tak riešeniach2 Vo vode sa vyskytujú nasledujúce zostatky:
SW2 + H2Alebo ⇔ tak2.H2Ani
SW2.H2Alebo ⇔ HSO3- + H3Ani+
HSO3- + H2Alebo ⇔ tak32- + H3Ani+
Kde HSO3- Je to bisulfitový ión a SO32- Je to sulfit ión. Sulfitový ión32- Vyskytuje sa hlavne, keď sa do roztoku SO pridá alkali2.
Vodné roztoky SOS2 Majú redukčné vlastnosti, najmä ak sú zásadité.
Ďalšie vlastnosti
- Je mimoriadne stabilný v porovnaní s teplom, dokonca až do 2000 ° C.
- Nie je to horľavé.
Získanie
Tak2 Získava sa spaľovaním síry vo vzduchu, hoci sa vytvárajú aj malé množstvá formy SO3.
S + O2 → SO2
Môže sa tiež vyrábať zahrievaním vo vzduchu rôznych sulfidov, horiacimi pyritovými minerálmi a minerálmi obsahujúcimi sulfidy, okrem iného.
V prípade železa pyritu, keď sa oxiduje oxid železa (III) a získanie SO2:
4 fes2 + 11 o2 → 2 viera2Ani3 + 8 SO2↑
Prítomnosť v prírode
Tak2 Uvoľňuje sa do atmosféry aktivitou sopiek (9%), ale tiež pochádza z iných prírodných aktivít (15%) a ľudskými akciami (76%).
Výbušné sopečné erupcie spôsobujú významné ročné výkyvy alebo variácie2 v atmosfére. Odhaduje sa, že 25% SO2 Emitovaný sopkami sa premyje dažďom pred dosiahnutím stratosféry.
Prírodné zdroje sú najhojnejšie a sú spôsobené biologickým cyklom síry.
V mestských a priemyselných oblastiach prevažujú ľudské zdroje. Hlavnou ľudskou aktivitou, ktorá ju produkuje, je pálenie fosílnych palív, ako je uhlie, benzín a nafta. Ďalšími ľudskými zdrojmi sú ropné rafinérie, chemické rastliny a výroba plynu.
 Ľudské činnosti, ako je spaľovanie uhlia pre elektrinu, sú zdrojom znečistenia so tým2. ADREM68 [CC BY-SA (https: // creativeCommons.Org/licencie/By-SA/4.0)]. Zdroj: Wikimedia Commons.
Ľudské činnosti, ako je spaľovanie uhlia pre elektrinu, sú zdrojom znečistenia so tým2. ADREM68 [CC BY-SA (https: // creativeCommons.Org/licencie/By-SA/4.0)]. Zdroj: Wikimedia Commons. U cicavcov sa vytvára endogénnym spôsobom, tj v tele zvierat a ľudí v dôsledku metabolizmu aminokyselín obsahujúcich síru (S), najmä L-cysteín.
Môže vám slúžiť: tekuté prvky: Čo sú a príkladyŽiadosti
Pri výrobe kyseliny sírovej
Jedna z najdôležitejších aplikácií SO2 Je pri získavaní kyseliny sírovej h2SW4.
2 SO2 + 2 h2Alebo + o2 → 2 h2SW4
V spracovanom potravinárskom priemysle
Oxid siričitý sa používa ako konzervačný a stabilizátor potravín, ako činidlo na kontrolu vlhkosti a ako modifikátor chuti a textúry určitých jedlých výrobkov.
Používa sa tiež na dezinfekciu zariadenia, ktoré prichádza do styku s potravinami, fermentačným zariadením, ako sú pivovary a životne dôležité, potravinové nádoby atď.
Umožňuje šetriť ovocie a zeleninu, zvyšuje jeho životnosť na poličke supermarketov, zabraňuje strate farby a chuti a pomáha pri zadržiavaní vitamínu C (kyselina askorbová) a karoténu (prekurzory vitamínu A).
 Sušené ovocie zostávajú bez húb a baktérií vďaka SO2. Autor: Isabel Ródenas. Zdroj: Pixabay.com
Sušené ovocie zostávajú bez húb a baktérií vďaka SO2. Autor: Isabel Ródenas. Zdroj: Pixabay.com Slúži na udržanie vína, pretože ničí baktérie, huby a nežiaduce kvasinky. Používa sa tiež na sterilizáciu a zabránenie tvorbe nitrozamínov v pive.
 Fermentačné vybavenie jačmeňa na získanie piva sterilizuje SO2. Autor: Ceridebbie. Zdroj: Pixabay.
Fermentačné vybavenie jačmeňa na získanie piva sterilizuje SO2. Autor: Ceridebbie. Zdroj: Pixabay. Používa sa tiež na nasiaknutie kukuričných zŕn, na bielenie cukru repy a ako antimikrobiálne pri výrobe kukuričného sirupu s vysokou fruktózou.
Ako rozpúšťadlo a reaktívne
Sa široko používa ako neacené rozpúšťadlo. Aj keď nejde o ionizujúce rozpúšťadlo, je užitočné ako rozpúšťadlo bez protónov pre určité analytické aplikácie a chemické reakcie.
Používa sa ako rozpúšťadlo a činidlo v organických, sprostredkovateľoch pri produkcii iných zlúčenín, ako je oxid chloričitého, acetylchlorid a sulfonácia oleja.
Ako redukčný činidlo
Používa sa ako redukčné činidlo napriek tomu, že nie je tak silný, a v alkalickom roztoku sa vytvára sulfit ión, ktorý je energetickejším redukčným činidlom.
V niekoľkých aplikáciách
Tak2 Používa sa tiež:
- V poľnohospodárstve, ako je fungicíd a konzervačné umenie hrozna po zbere.
- Na výrobu hydrosulfitu.
- Na bielenie dreva a papierovej buničiny, pretože umožňuje stabilizáciu buničiny po praní peroxidom vodíka H2Ani2; Tak2 koná zničením H2Ani2 zvyšok, a tak si udržiavajte jas buničiny, ako H2Ani2 môže spôsobiť zvrátenie jasu.
- Na bielenie textilných vlákien a prútených článkov.
- Na ošetrenie vôd eliminuje zvyškový chlór, ktorý zostáva po chlorácii pitnej vody, odpadovej vody alebo priemyselných vôd.
- Pri rafinácii minerálov a kovov, ako činidlo redukcie železa počas spracovania minerálov.
- Pri rafinácii oleja na zachytenie kyslíka a oneskorenie korózie a ako extrakčné rozpúšťadlo.
Môže vám slúžiť: Vyváženie chemických rovníc- Ako antioxidant.
- Ako alkalis neutralizátor vo výrobe skla.
- V lítiových batériách ako oxidačné činidlo.
Účinky tak2 endogénny
Niektoré štúdie odhalili, že SO2 Endogénny alebo produkovaný samotným organizmom má priaznivý vplyv na kardiovaskulárny systém vrátane regulácie funkcie srdca a relaxácie krvných ciev.
Keď sa tak vyskytne v organizme2 Stáva sa jej derivátmi bisulfitov HSO3- a sulfite tak32-, ktoré vyvíjajú vazorelajadorský účinok tepien.
Tak2 Endogénny znižuje hypertenziu, zabraňuje rozvoju aterosklerózy a chráni srdce poškodenia myokardu. Vyvíja tiež antioxidačný účinok, inhibuje zápal a apoptózu (naprogramovaná bunková smrť).
Z týchto dôvodov sa predpokladá, že to môže byť možná nová terapia kardiovaskulárnych chorôb.
 Srdce môže mať úžitok zo SO2 Vyrábané organizmom. Autor: OpenClipart-vektory. Zdroj: Pixabay.
Srdce môže mať úžitok zo SO2 Vyrábané organizmom. Autor: OpenClipart-vektory. Zdroj: Pixabay. Riziká
- Vystavenie tomuto2 Plyn môže viesť k popáleninám v očiach, koži, krku a slizniciach, poškodenie bronchi a pľúc.
- Niektoré štúdie uvádzajú, že má potenciálne riziko poškodenia genetického materiálu cicavcov a ľudských buniek.
- Je to korozívne. Nie je to horľavé.
Ekotoxicita
Oxid siričitého je najbežnejším plynom znečisťujúcich látok v atmosfére, najmä v mestských a priemyselných oblastiach.
Jeho prítomnosť v atmosfére prispieva k takzvanému „kyslému dážďu“, ktorý je škodlivý pre vodné organizmy, ryby, pôdu vegetáciu a koróziu k materiálom vyrobeným ľudskou bytosťou.
 Pamätník poškodený kyslým dažďom. Nino Barbieri [CC By-S (http: // creativeCommons.Org/licencie/By-SA/3.0/]]. Zdroj: Wikimedia Commons.
Pamätník poškodený kyslým dažďom. Nino Barbieri [CC By-S (http: // creativeCommons.Org/licencie/By-SA/3.0/]]. Zdroj: Wikimedia Commons. Tak2 Je toxické pre ryby. Zelené rastliny sú na to mimoriadne citlivé2 atmosférický. Alfalfa, bavlna, jačmeň a pšenica sú poškodené nízkou úrovňou životného prostredia, zatiaľ čo zemiaky, cibuľa a kukurica sú oveľa odolnejšie.
Účinky požitia jedlom
Aj keď je to neškodné pre zdravých ľudí, ak sa používa v koncentráciách odporúčaných autorizovanými zdravotníckymi agentúrami, SO2 môže vyvolať astmu citlivým ľuďom, ktorí ju prijímajú jedlom.
 Citliví ľudia môžu trpieť astmou požitím potravín s malým množstvom2. Suraj v Malayalam Wikipedia [verejná doména]. Zdroj: Wikimedia Commons.
Citliví ľudia môžu trpieť astmou požitím potravín s malým množstvom2. Suraj v Malayalam Wikipedia [verejná doména]. Zdroj: Wikimedia Commons. Potraviny, ktoré ich zvyčajne obsahujú, sú sušené ovocie, umelé nealkoholické nápoje a alkoholické nápoje.
Odkazy
- Alebo.Siež. Lekárska knižnica. (2019). Oxid. Obnovený z pubchem.Ncbi.NLM.NIH.Vláda.
- Huang a. a kol. (2016). Endogénny oxid siričitého: Nová zjemníka rodiny Gasotransmiter v kardiovaskulárnom systéme. Oxidný dlhý čas. 2016; 2016: 8961951. NCBI sa zotavila.NLM.NIH.Vláda.
- Bavlna, f. Albert a Wilkinson, Geoffrey. (1980). Pokročilá anorganická chémia. Štvrté vydanie. John Wiley & Sons.
- Windholz, m. a kol. (redaktori) (1983). Index Merck. Enyklopedia chemikálií, liekov a biologických. Desiate vydanie. Merck & Co., Inc.
- Chlieb, x. (2011). Oxidy Síra: Zdroje, expozície a účinky na zdravie. Účinky zdravotných oxidov síry. V encyklopédii zdravia životného prostredia. Zotavené z vedeckých pracovníkov.com.
- Tricker, R. a podvodník, s. (1999). Znečisťujúce látky a kontaminanty. Oxid siričitý. V environmentálnych požiadavkách na elektromechanické a elektronické vybavenie. Zotavené z vedeckých pracovníkov.com.
- Bleam, W. (2017). Chémia. Oxidy síra. V pôde a environmentálnej chémii (druhé vydanie). Zotavené z vedeckých pracovníkov.com.
- Freedman, b.J. (1980). Oxid siričitý v potravinách a nápojoch: jeho používanie konzervatívnosti a jeho vplyv na astmu. Br J Dis hrudník. 1980; 14 (2): 128-34. NCBI sa zotavila.NLM.NIH.Vláda.
- Craig, K. (2018). Preskúmanie chémie, používania pesticídov a osudu environmentálneho oxidu siričitého, ako sa používa v Kalifornii. V prehľadoch kontaminácie a toxikológie životného prostredia. Zväzok 246. Odkaz obnovený.Prubár.com.
- « Štruktúra kremíka nitruro (SI3N4), vlastnosti, získanie, použitie, použitia
- Hliníková štruktúra polyloridu, vlastnosti, získanie, použitie, použitia »

