Dibenzalacetona vlastnosti, reakčný mechanizmus, použitie, riziká

- 2133
- 77
- MUDr. Miloslav Habšuda
Ten Dibenzalacetona (DBA) je organická zlúčenina, ktorej molekulárny vzorec je C17H14Ani. Je to žltkastá pevná látka, ktorá môže byť v závislosti od jeho čistoty prezentovaná ako kryštály. Používa sa v opaľovacích krhoch a organometalovej syntéze, v ktorej sa paladium používa ako katalyzátor.
Aj keď je jeho syntéza relatívne jednoduchý, celkom opakujúci sa proces vo výučbových laboratóriách na vysvetlenie aldolickej kondenzácie, jej mechanizmus je trochu rozsiahly, malo by sa zohľadniť niekoľko faktorov. Benzaldehyd, ktorý sa používa, ktorý bude kondenzovať s acetónom, musí byť novo destilovaný, aby sa zaručila jeho nízka oxidácia v kontakte so vzduchom.
 Vzorka dibenzalacetona v sklenenej nádobe. Zdroj: Stephanb [CC BY-SA (http: // creativeCommons.Org/licencie/By-SA/3.0/]]
Vzorka dibenzalacetona v sklenenej nádobe. Zdroj: Stephanb [CC BY-SA (http: // creativeCommons.Org/licencie/By-SA/3.0/]] Podobne sa na rozpustenie reagencií používa médium etanol-voda a súčasne podporuje konečné zrážanie dibenzalacetónu, hydrofóbnej a nerozpustnej zlúčeniny. Doteraz nie je známe, aké negatívne účinky môžu skôr cvičiť dibenzalaceton na organizmus alebo životné prostredie, a nie je to dráždivosť.
[TOC]
Vlastnosti
Fyzický vzhľad
Mastný žltkastý prašný alebo kryštalický vzhľad.
Molárna hmota
234,29 g/mol
Izoméry
Dibenzalacetón je prezentovaný ako tri geometrické izoméry: Trans-trans-trans-Trans-CIS a CIS-CIS. Izomér trans-trans je najstabilnejší, a preto ten, ktorý sa vyskytuje najviac počas syntézy.
Bod topenia
110-111 ° C. Tento rozsah sa líši v závislosti od stupňa čistoty syntetizovanej tuhej látky.
Rozpustnosť
Nerozpustný.
Štruktúra
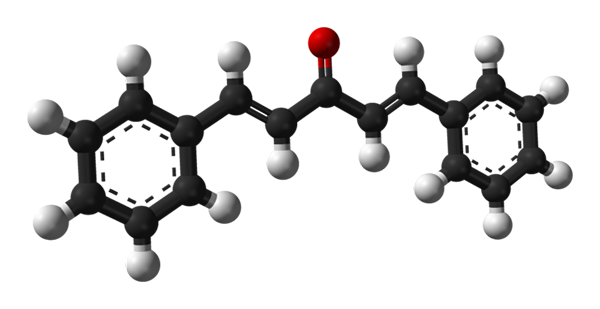 Molekulárna štruktúra dibenzalacetónu. Zdroj: Benjah-Bmm27 [verejná doména]
Molekulárna štruktúra dibenzalacetónu. Zdroj: Benjah-Bmm27 [verejná doména] Na hornom obrázku je znázornená molekula trans-trans-trans-trans-trans-trans-trans-transm. V centre máme karbonylovú skupinu a na svojich stranách dvojité putá a dva aromatické bonencene prstene.
Dibenzalacetón je v apolárnej a hydrofóbnej podstate, pretože celá jeho štruktúra je prakticky zložená z atómov uhlíka a vodíka. Karbonylová skupina mu dáva len malý dipólový okamih.
Môže vám slúžiť: hliníkový fosfuro (AIP): štruktúra, vlastnosti, použitia, rizikáŠtruktúra sa môže prirovnať k štruktúre plechu, pretože všetky jej atómy uhlíka majú hybridizáciu SP2; Preto odpočívajú v rovnakom lietadle.
Svetelné fotóny interagujú s konjugovaným π systémom dibenzalacetona; Najmä tie, ktoré sa utrhlo, absorbované na excitáciu premiestnených elektrónov. Táto vlastnosť robí z Dibenzalacetona vynikajúci absorbent ultrafialového svetla.
Mechanizmus reakcie dibenzalacetona
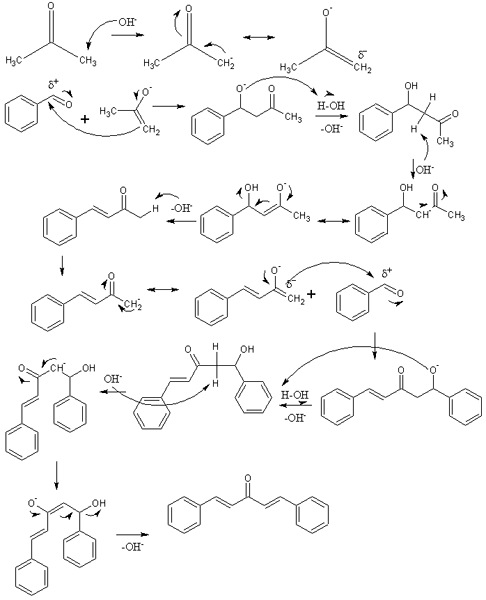 Mechanizmus aldolovej kondenzácie pri syntéze dibenzalacetona. Zdroj: Izmaelt [CC By-S (https: // creativeCommons.Org/licencie/By-SA/3.0)]
Mechanizmus aldolovej kondenzácie pri syntéze dibenzalacetona. Zdroj: Izmaelt [CC By-S (https: // creativeCommons.Org/licencie/By-SA/3.0)] V nadradenom obraze sme predstavovali mechanizmus aldolovej kondenzácie medzi benzaldehydom a acetónom, aby sme vznikli dibenzalacetónu; konkrétne jeho trans-trans-trans-izomér.
Reakcia začína acetónom v základnom médiu. Oh- Nespojte kyslý protón jednej z jej dvoch metylových skupín, -ch3, Vráťte k inolátu: Cho3C (o) ch2-, ktorý premiestni svoje záporné rezonančné zaťaženie (prvý riadok obrázka).
Toto inolát potom pôsobí ako nukleofilné činidlo: útočí na karbonylovú skupinu molekuly benzaldehydu. Jeho začlenenie do benzaldehydu generuje alcoxid, ktorý, pretože je veľmi základný devastujúca molekula vody a stáva sa aldolom (druhý riadok). Aldol alebo β-hydroxychitón sa vyznačuje tým, že má skupiny C = o a OH.
Základné médium dehydratuje tento aldol a dvojitá väzba sa tvorí vo svojej štruktúre, ktorá generuje benzylideneacetón (tretí riadok). Potom, oh- Tiež nechránený jeden z jeho kyslých hydrogénov, opakuje ďalší nukleofilný útok na druhú molekulu benzaldehydu. Tentoraz sa útok uskutoční tak rýchlo (štvrtý riadok).
Produkt vytvoril nechránenú ďalšiu molekulu vody a opäť utrpí dehydratáciu na odstránenie skupiny OH a vytvorenie druhej dvojitej väzby (piate a šiesty riadky). Teda a nakoniec, dochádza k dibenzalacetone.
Môže ti slúžiť: Boyle LawSyntéza
Činidlá
Reagenty na vykonanie syntézy dibenzalacetónu sú nasledujúce:
- 95% etanol.
- Novo destilovaný benzaldehyd horkého mandľového oleja.
- NaOH ako základný katalyzátor v destilovanej vode.
Sumy, ktoré sa majú použiť. Existuje však prebytok benzaldehydu, pretože jeho časť je oxidovaná na kyselinu benzoovú. Je tiež zaručené, že reakcia trvá menej času a že nežiaduci benzylideneacetón sa vytvára v menšej miere.
Etanol pôsobí ako rozpúšťadlo benzaldehydu, pretože inak by sa nerozpustil v základnom prostredí NaOH.
Postup
Vo veľkom zrazenom skle sa etanol zmieša s benzaldehydom. Potom sa pri konštantnom magnetickom agitácii pridá základné médium NaOH. V tomto kroku dôjde k reakcii v Cannizzaro; To znamená, že dve benzaldehydové molekuly sa neviazajú v jednom z benzylalkoholu a druhej z kyseliny benzoovej, ľahko rozpoznateľné jej charakteristickou sladkou vôňou.
Nakoniec sa pridá acetón a očakáva sa pol hodiny, aby sa roztok stal zamračený a žltá oranžová farba. Dibenzalacetona sa bude zrážať v dôsledku vody, takže sa pridá značný objem vody na podporu jej úplných zrážok.
Dibenzalacetona filtruje do vákua a jeho žltkastá tuhá láva niekoľkokrát s destilovanou vodou.
Rekryštalizácia
 Rekryštalizovaná vzorka Dibenzalacetona musí nosiť lesk podobný ako v kryštáloch tohto obrázka. Zdroj: Smokefoot [CC By-SA (https: // creativeCommons.Org/licencie/By-SA/4.0)]
Rekryštalizovaná vzorka Dibenzalacetona musí nosiť lesk podobný ako v kryštáloch tohto obrázka. Zdroj: Smokefoot [CC By-SA (https: // creativeCommons.Org/licencie/By-SA/4.0)] Na očistenie dibenzalacetónu sa používa 95% etanol alebo horúci etylacetát, takže sa získava viac kryštálov čistoty pri každom opakovaní rekryštalizácie. Počiatočný žltkastý prach sa teda transformuje na malé žlté kryštály Dibenzalacetona.
Môže vám slúžiť: Kyselina benzoová (C6H5COOH)Žiadosti
Dibenzalacetona je zlúčenina, ktorá nemá príliš veľa použití. Vďaka svojej schopnosti absorbovať ultrafialové svetlo sa používa pri formulácii opaľovacieho krému alebo akéhokoľvek iného produktu, ktorý plánuje výskyt UV lúčov, buď povlaky alebo maľby.
Na druhej strane sa dibenzalacetón používa v organometalickej syntéze paladia. Pôsobí ako väzba, ktorá koordinuje atómy kovového paladia, PD0, Na vytvorenie komplexu Tris (dibenzeneacetona) Dipaladio (0).
Táto organometalická zlúčenina poskytuje atómy PD0 V rôznych organických syntézach, takže sa správa ako homogénny katalyzátor, pretože sa rozpúšťa v mnohých organických rozpúšťadlách.
Podobne sa Dibenzalacetona ako spojivo ľahko nahradí inými organickými spojivami, čo umožňuje vyvinúť organometalickú syntézu paladia.
Riziká
Pokiaľ ide o riziká, nie je k dispozícii veľa informácií, ktoré správy o možných vplyvoch na zdravie alebo životné prostredie, ktoré môžu viesť k dibenzalacetone. Vo svojom čistom stave je dráždivou pevnou látkou pre požitie, dýchanie alebo priamy kontakt s očami alebo pokožkou.
Nie je to však zjavne dosť dráždivé, aby nemohla byť súčasťou formulácií slnečných krémov. Na druhej strane, keď je tak nerozpustný vo vode, je jej koncentrácia v nej zanedbateľná a predstavuje sa ako pevná kontaminant. V tomto zmysle nie je známe, aké škodlivé je to pre morskú faunu alebo pôdy, ktorá spôsobuje zákal.
Kým nie je preukázaný opak.
Odkazy
- Morrison, r. Tón. a Boyd, R, N. (1987). Organická chémia. 5. vydanie. Redakčný Addison-Wesley Inter-American.
- Carey F. (2008). Organická chémia. (Šieste vydanie). MC Graw Hill.
- Graham Solomons t.W., Craig B. Fryhle. (2011). Organická chémia. (10. vydanie.). Wiley Plus.
- Wikipedia. (2020). Dibenzylideneacetón. Zdroj: In.Wikipedia.orgán
- Národné centrum pre biotechnologické informácie. (2020). Dibenzylideneacetón. Databáza pubchem., CID = 640180. Získané z: pubchem.Ncbi.NLM.NIH.Vláda
- Organické syntetiky. (2020). Dibenzalacetón. Zdroj: Orsyn.orgán
- Dibenzalacetón kondenzáciou Aldol. Zdroj: Web.MnState.Edu
- « Charakteristiky tepelného znečistenia, dôsledky, príklady
- Základy jodometrie, reakcie, všeobecný postup, použitie »

