Základy, typy, aplikácie Coulombometry

- 4407
- 168
- Adrián Fajnor
Ten Coulombimetria Je to technika elektrochemickej analýzy, ktorá spočíva v vykonávaní vyčerpávajúcej elektrolýzy, aby sa analyt mohol kvantifikovať; to znamená určiť koncentráciu analytu v problémoch s úplnou oxidáciou alebo redukciou. Na rozdiel od potenciometrie je to dynamická technika, pretože prúd sa voľne preteká elektrochemickými bunkami.
Ako už názov napovedá, elektrický náboj Q, v jednotkách Coulomb, sa meria a koreluje s koncentráciou oxidovaného alebo zníženého analytu v perifériách elektród. Preto oxidačné stavy zmeny analytu, ktoré sa vyskytujú v procese, prenos a absorpcia elektrónov, ktorý umožňuje stechiometrický výpočet požadovanej koncentrácie.
 Základná zostava pre elektrolýzu, v ktorej sa tvorí niekoľko farebných druhov kvôli pH a komplexácii lesov prítomných. Zdroj: Steve Jurvetson z Menlo Park, USA, CC BY 2.0, cez Wikimedia Commons
Základná zostava pre elektrolýzu, v ktorej sa tvorí niekoľko farebných druhov kvôli pH a komplexácii lesov prítomných. Zdroj: Steve Jurvetson z Menlo Park, USA, CC BY 2.0, cez Wikimedia Commons V coulombimetrii sa na reguláciu prúdu alebo potenciálu aplikovaného na bunky používa batéria alebo potenciostat. Tieto bunky, na rozdiel od potenciometrických, pozostávajú zo systému s tromi elektródami a sú vybavené voltmetrom a ampérom.
Coulombimetria predstavuje výhodu, že je schopný vykonávať stupne bez prípravy alebo štandardizácie vzorov. Umožňuje tiež kvantifikáciu veľmi malé a obmedzené množstvá analytu, ako sú kovové katióny, anorganické zlúčeniny a organické zlúčeniny. Napríklad existuje coulometer navrhnutý výlučne na meranie CO2 rozpustené vo vzorkách z oceánu.
Táto technika ponúka inú analytickú cestu ako volumetrickú a potenciometrickú, takže veľa analýz, v závislosti od elektrochemického charakteru analytu, sa môže vyvinúť coulombimetricky.
Teoretické základy coulombimetrie
Faradayov zákon
Coulombimetria je založená na Faradayovom zákone, ktorý vytvára vzťah medzi elektrickým nábojom elektrochemickej bunky a množstvom analytu, ktorý oxiduje alebo redukuje. Poznanie tohto zaťaženia Q, ako aj zaťaženie elektrónu (1.6 · 10-19 C), môžete vypočítať počet elektrónov zapojených do reakcie, na-:
na- = Q/e
Na druhej strane je známe, že jeden mol elektrónov (6.02 · 1023) Porta Elektrický náboj rovný 96485 C, číslo známa ako Faraday Constant:
F = vDo
= 96485.3365 c/mol
Je vhodné vyjadriť množstvo elektrónov v závislosti od mólov. Vďaka tomu môžu byť použité stechiometrické koeficienty elektrochemickej reakcie, oxidácia alebo redukcia, pričom sa berú do úvahy, koľko mólov elektrónov vyhrá alebo stratia tento druh.
Môže vám slúžiť: fosforečnan sodný: štruktúra, vlastnosti, syntéza, použitieZákladné výpočty
Zvážte napríklad nasledujúcu chemickú rovnicu:
Ox + 2e- → Sieť
Zmeranie, že keď sa celý druh Ox zmenší na sieť, môžeme vypočítať móly vola pomocou konverzných faktorov:
xq · (mol e- /96485.3365 c) · (mol ox/ 2mol e-) = mol ox
To znamená, že ako vieme elektrický náboj za mol elektrónov, budeme mať, koľko elektrónov zodpovedá zaťaženiu XQ. Ale zase sa každé 2 móly týchto elektrónov používajú na oxidáciu 1 molu Ox.
Toto zdôvodnenie spôsobuje priamy vzorec, aj keď sa neodporúča si ho zapamätať, ale je schopný ho odvodiť tak, ako sa to stalo:
n = Q/(fña-)
Kde ña- Je to počet mólov elektrónov v chemickej rovnici.
Za predpokladu, že sa dá vypočítať q, bez ohľadu na typ coulombimetrie, je možné určiť móly OX alebo sieťovej analytu; Pokiaľ je účinnosť prúdu 100%. Posledne menované znamená, že všetky zaťaženie, ktoré musí byť produktom iba jednej transformácie, bez toho, aby sa znížil alebo oxidoval iné druhy.
Experimentálne základy coulombimetrie
Bunky
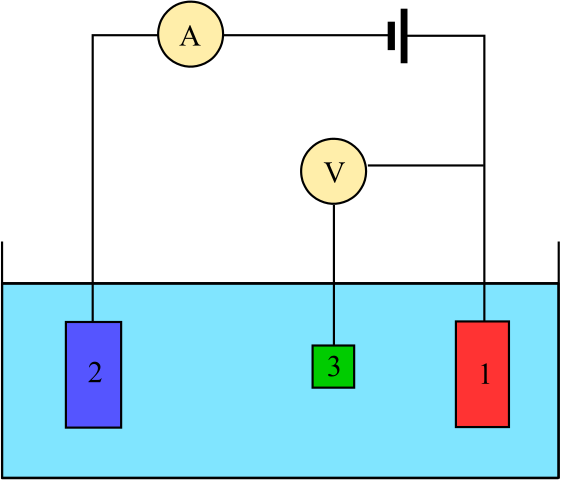 Schéma pre elektrochemickú bunku zloženú z troch elektród: referencia (3), asistent (2) a práca (1). Zdroj: Adam Rędikowski, CC BY-SA 3.0, cez Wikimedia Commons
Schéma pre elektrochemickú bunku zloženú z troch elektród: referencia (3), asistent (2) a práca (1). Zdroj: Adam Rędikowski, CC BY-SA 3.0, cez Wikimedia Commons Hore máme diagram pre bunku s tromi elektródami, ktorá sa bežne používa v coulombemetrických analýzach. Redoxná reakcia prebieha medzi pracovnými elektródami (1) a pomocným (2). Medzi nimi dvaja sú pripojení batéria, aby sa použili potenciály na bunku a ampérové (A) na meranie elektrických prúdov.
Je však potrebná referenčná elektróda (3), aby bola schopná monitorovať potenciál pracovnej elektródy, a teda poznať variáciu potenciálu pre pomocnú elektródu. Týmto spôsobom je možné určiť potenciál celej bunky abunka, potrebné na odhad konca redoxných reakcií v jednom z typov coulombimetrie.
Všimnite si, že medzi pracovnou elektródou a referenčnou elektródou takmer nepreteká prúd v dôsledku vysokého impedančného voltmetra (V), vďaka čomu existuje čítanie potenciálu pre pracovnú elektródu. Medzi týmito dvoma elektródami máme systém podobný systému potenciometrickej analýzy: je statický a nie dynamický.
Môže vám slúžiť: jadrová chémia: História, štúdium, oblasti, aplikáciePotenciál
Coulombimetria je tak povedané elektrolýzou vykonávanou na analytické a kvantitatívne účely. Preto sa hovorí o použití vonkajších potenciálov dodávaných batériou na vykonávanie ne -kontemických elektrochemických reakcií; to znamená, že tí, ktorí majú negatívny potenciál.
Zoberme si napríklad nasledujúce reakcie sprevádzané ich príslušnými potenciálnymi normami:
Cu2+ + 2e- ⇌ cu (s) e .mriežka = +0.337 V
H2Alebo ⇌ 1/2o2g) + 2h+ + 2e- Eºmriežka = +1.230 V
Byť rovnicou globálnej reakcie rovná::
Cu2+ + H2Alebo ⇌ cu (s) + 1/2o2g) + 2h+ Eºmriežka = -0.893 V
Batéria musí použiť potenciál 0.893 V, aby bola možná medená elektróda a tvorba vodíkových iónov. Tento potenciál je ebunka. V praxi sa však musí uplatniť potenciál väčší ako vypočítaný, pretože existujú potenciály, ktoré sú proti vývoju reakcie:
Abunka = Ekatóda - Aanóda - OP - IR - CP
Kde,
OP: Nadmerná (kinetická bariéra)
IR: OHMIC (vnútorný potenciál pre bunky)
CP: Polarizácia koncentrácií (produkt poklesu v Cu2+)
Typy coulombimetrie
Existujú tri typy coulombimetrie: amperostatické, potenciostatické a elektrogravimetrické.
Amperostatický alebo galvanostatický
V tomto type coulombimetrie je prúd, ktorý prechádza bunkou, konštantný pomocou amperostatu. Preto mať prúd Jo Vďaka čítaniu Ammeter a tiež poznať čas tón Po ukončení elektrolýzy môžeme vypočítať zaťaženie spojené s transformáciou analytu:
Q = Položka
Dôsledkom udržiavania súčasnej konštanty je to, že elektródy potenciálne menia, buď pozitívne alebo negatívne. Táto náhla variácia naznačuje, že analyt úplne reagoval, čo je, keď sa elektrolýza zastaví a meria sa tón. To je základ pre coulometrické stupne.
Ak potenciál bude pokračovať alebo nahrávaním, ďalšie nežiaduce elektroaktívne druhy skončia reagovaním. Preto by mali byť potenciály spojené s transformáciami záujmov úplne známe.
Potenciostatický
Jeden spôsob, ako zabrániť iným druhom. Práve tu vstupuje potenciozotická coulombimetria, pretože používa potenciostet na stanovenie určitého potenciálu pre bunku. Na rozdiel od amperostatickej coulombimetrie je teraz súčasný, ktorý sa mení, keď sa čas stane.
Môže vám slúžiť: toluén: štruktúra, vlastnosti, použitie, získanieZ dôvodu tejto technickej konfigurácie to nemôžeme vypočítať priamo s hodnotami Jo a tón; Prúd sa časom znižuje. Je to preto, že ako reaguje analyt, bude menej a menej molekúl alebo atómov, ktoré darujú alebo akceptujú elektróny. Preto sa rovná integrálnej oblasti pod grafickou krivkou Jo vs tón.
Elektrografický
Elektrografická coulombimetria, jednoducho známa ako elektrogravimetria, je elektrolýza, v ktorej nie je potrebné merať zaťaženie alebo elektrické prúdy. Namiesto toho sa hmotnosti elektród merajú pred a po elektrolýze.
Táto technika sa uplatňuje iba vtedy, keď sa redukcia druhov zredukuje kovové katióny, ktoré sú elektródami elektród.
Žiadosti
Potenciostetický
Potentiostetické analýzy umožňujú redukciu alebo oxidovanie selektívne jeden druh v strede zmesi. Napríklad sa používajú na stanovenie koncentrácie nasledujúcich anorganických iónov v stopách alebo v komplexných matriciach:
-Cu2+
-Ace3+
-CD2+
-Co2+
-Vernosť2+ A viera3+
-Pb2+
-X (f-, Cl-, Br- a ja-)
-Ani2+
-Pluk3+
-Zápis+
-Sn2+
-Zn2+
-Alebo6+
Tieto analýzy sa tiež môžu použiť na určenie zloženia zliatiny. Akonáhle je zliatina kyseliny rozpustená, bunkové potenciály sa aplikujú rozloženým a kontrolovaným spôsobom, čím sa určuje znížené množstvo pre každý kovový katión, ktorý ho integruje.
Coulometrické stupne
V coulometrických stupňoch sa používajú sprostredkovateľské činidlá, ktoré sa uistia, že úplne neutralizujú alebo reagujú so zostávajúcimi analytmi. Účelom je zabrániť potenciálnym variáciám, do konštantného prúdu, odvodené v kolaterálnych reakciách. Je teda možné, že je možné držiak, napríklad kyselina askorbová, ktorá používa jód ako sprostredkovateľ.
Niektoré kovové katióny, napríklad AG+, ES3+, Vernosť3+, Mn2+, Vy3+, Cr2+, Môžu byť tiež určené týmito stupňami.
Na druhej strane, reakcie na báze kyseliny môžu túto techniku stále používať, pretože veľké potenciály spôsobujú iónovú vodu3Ani+ alebo oh-, ktoré slúžia z titulov agentov, ktorí sa generujú in situ; to znamená, že neutralizujú prítomné kyseliny alebo prítomné základne.
CO2 z oceánu sú možné zrážkové reakcie a tvorba komplexov s EDTA ich analyzovať aj použitím coulometrických stupňov, kde sa pridávajú redoxné ukazovatele, aby sa zvýraznil konečný bod elektrolýzy.
Odkazy
- Deň, r., & Underwood, a. (1986). Kvantitatívna analytická chémia (Piate ED.). Pearson Prentice Hall.
- Džbán.Do., Západný D.M. (1986). Inštrumentálna analýza. (Druhé vydanie.). Medziprítomský., Mexiko.
- DR. Doug Stewart. (2020). Definícia coulometrie. Získané z: Chemicool.com
- Wikipedia. (2020). Coulometria. Zdroj: In.Wikipedia.orgán
- Harvey David. (5. júna 2019). Coulometrické metódy. Chémia librettexts. Získané z: Chem.Librettexts.orgán
- « Metodologický rámec, ako ho napísať, štruktúra, príklady
- Pôvod súčasnej filozofie, charakteristiky, prúdy, autori »

