Konštantná rýchlosť

- 4227
- 1342
- Tomáš Mydlo
Aká je rýchlostná konštanta?
Ten konštantná rýchlosť Je to konštanta proporcionality zákona o rýchlosti chemickej kinetiky, ktorá stanovuje vzťah medzi molárnou koncentráciou reagencií a rýchlosťou reakcie.
Ako reagencie, reakčné rýchlosti konzumujú, tiež znižujú. Preto vo výpočtoch rýchlosti konštanty, reprezentovanej symbolom „k“, sa berú do úvahy počiatočné rýchlosti, aby sa medzi niekoľkými experimentmi mal porovnávací bod medzi niekoľkými experimentmi.

Chemická kinetika naznačuje, že táto konštanta závisí od reakčných rádov činidiel, ktorých koncentrácie budú meniť rýchlosť reakcie. Na druhej strane, podľa Arrheniusovej rovnice, K tiež závisí od teploty a aktivačnej energie pre reakciu.
Preto sa hovorí, že rýchlostná konštanta nie je skutočná konštanta, pretože sa mení s teplotou a tiež prítomnosťou katalyzátorov, ktoré modifikujú aktivačnú energiu. Preto nie je veľa tabuliek, kde prichádzajú na špecifické reakcie (a podmienky).
Napríklad pre reakciu, kde reaguje A a B, každá s poradím reakcie 1, konštanta hlásená K až 25 ° C as pridaním určitého množstva katalyzátora nebude rovnaká, ak reakcia je vyrobený na teplotu 26 alebo 27 ° C. Najmenšia variácia ovplyvní hodnotu k, ktorá je konštantná iba za podmienok stanovených pre experimenty.
Ako vypočítať rýchlostnú konštantu?
Experimentovanie
Stanovenie hodnoty rýchlosti konštanty reakcie sa uskutočňuje experimentálne. Ak napríklad chcete určiť hodnotu rýchlosti konštanty pre reakciu formulára:
A +B → C
Na stanovenie hodnoty K je možné vykonať tri reakcie s nasledujúcimi rozdielmi: v reakcii 2 je počiatočná koncentrácia činidla A konštantná, [a], ale zdvojnásobí sa, napríklad koncentrácia činidla B, [ B].
Medzitým sa v reakcii 3 [a] zdvojnásobí v porovnaní s reakciou 1, pričom sa udržiava konštantná [b].
Teda sa vytvorí tabuľka koncentrácií, ktorá bude slúžiť na porovnanie počiatočných rýchlostí medzi niekoľkými experimentmi. To s cieľom určiť reakčné príkazy a postupne na výpočet rýchlosti konštanty.
Môže vám slúžiť: hydroxid z hliníka: štruktúra, vlastnosti, použitia, rizikáReakčné príkazy
Prvé výpočet
Pre predchádzajúcu reakciu je jeho rýchlosť vyjadrená rovnicou:
Rýchlosť reakcie = k · [a]X· [B]a
Kde 'x' e 'a' zodpovedajú reakčným príkazom pre reagenty A a B, respektíve.
Na stanovenie hodnôt reakčných rádov sa musí vykonať porovnanie medzi reakciou 2 a 1, ako aj medzi reakciou 3 a 1.
Pri porovnaní reakcie 1 s 2 sa dá poznamenať napríklad, že duplikovaním [b] existuje duplikácia reakčnej rýchlosti.
Potom: podiel [B] medzi reakciami 2 a 1 je 2, ako aj pomer medzi rýchlosťami reakcií. Potom je možné získať hodnotu objednávky reakcie s ohľadom na B (exponent a) prostredníctvom nasledujúceho prístupu:
 Výpočet poradia reakcie 'a'. Zdroj: Gabriel Bolívar.
Výpočet poradia reakcie 'a'. Zdroj: Gabriel Bolívar. Rýchlosť experimentu 2 je dvakrát rýchlejšia ako rýchlosť experimentu 1. Takto vydelenie dvoch vyššie uvedených rovníc budeme mať:
2 = 2a
Preto „a„ Vale 1, ktorý je schopný dospieť k záveru, že poradie reakcie vzhľadom na činidlo B je prvého poriadku.
Druhá výpočet
Rovnakým spôsobom pokračujeme v činidle A pre výpočet „x“:
 Výpočet poradia reakcie „x“. Zdroj: Gabriel Bolívar.
Výpočet poradia reakcie „x“. Zdroj: Gabriel Bolívar. Rýchlosť experimentu alebo reakcie 3 je štyrikrát vyššia ako experiment alebo reakcia 1. Preto:
4 = 2X
Ani
22 = 2X
A hodnota x je 2, takže reakcia je druhý poriadok vo vzťahu k činidlam.
Konečné zúčtovanie
Potom je možné stanoviť hodnotu rýchlosti konštanty založenej na ktorejkoľvek z reakcií:
Rýchlosť reakcie = k · [a]2· [B]
Dosť na zavedenie experimentálnych hodnôt a jasné k:
K = rýchlosť reakcie / ([a]2· [B])
Príklady
Nasledujúce príklady slúžia ako úvod pred vyriešenými cvičeniami z nasledujúcej časti.
Príklad 1
V chemickej reakcii:
a) Ak sa počiatočná koncentrácia činidla zdvojnásobí rýchlosť reakcie: aké je poradie reakcie vzhľadom na toto činidlo?
b) Ak zvýšenie koncentrácie činidla spôsobí zvýšenie rýchlosti faktora 8, aké by bolo poradie reakcie potom?
c) Ak koncentrácia činidla zažije zmenu a rýchlosť zostáva rovnaká: aké je poradie reakcie vzhľadom na činidlo?
Môže vám slúžiť: cykopropán (C3H6)V a) podiel reakčných rýchlostí je rovnaký a podiel koncentrácií činidla sa rovná 2X,
2 = 2X
Preto x = 1 a poradie reakcie vzhľadom na činidlo je 1.
V b) podiel reakčnej rýchlosti je rovnaký 8 (23) a podiel koncentrácií činidla sa rovná 2X,
23 = 2X
Preto x = 3 a poradie reakcie vzhľadom na činidlo je 3-
Zatiaľ čo v C) rýchlosť reakcie je nezávislá od koncentrácie činidla, takže poradie reakcie vzhľadom na činidlo je nula.
Príklad 2
Reakcia:
2 Nie2 + Ani2 → 2 Nie2
Má vyjadrenie nasledujúceho zákona o rýchlosti:
Rýchlosť reakcie = k · [nie2]2· Buď2.
Aký je globálny poriadok reakcie? Aké jednotky by mali?
Poradie reakcie týkajúcej sa alebo2 Je to 1 a poradie reakcie vzhľadom na nie2 Je to 2, takže globálne poradie reakcie je súčet týchto hodnôt, tj 2 + 1 = 3.
Rýchlosť reakcie má m/s jednotky a koncentrácie reagencií sú vyjadrené v m. Analýza jednotiek, ktoré budeme mať:
k = rýchlosť reakcie / ([nie2]2· [Buď2]
= (M / s) / (m3)
= s-1M-2
Vyriešené cvičenia
Cvičenie 1
Údaje nasledujúcej reakcie sa získali pri 25 ° C:
A +2 B → C +2 D
Aký je prejav zákona o rýchlosti tejto reakcie? Aká je hodnota vašej rýchlosti konštanty?
Výpočty reakčných príkazov
Experimentálne údaje sú:
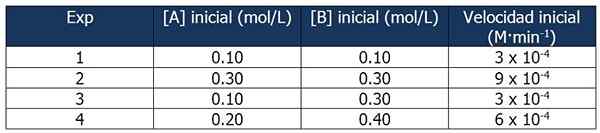 Cinetické údaje o cvičení 1. Zdroj: Gabriel Bolívar.
Cinetické údaje o cvičení 1. Zdroj: Gabriel Bolívar. Porovnanie experimentov 1 a 3 vám umožňuje vyvodiť tieto závery:
Podiel medzi rýchlosťami reakcií 3 a 1:
3 x 10-4 M · min-1 / 3 x 10-4 M · min-1 = 1
Ale podiel medzi koncentráciami B je:
(0.3 mol / l) / (0.1 mol/l) = 3
Rýchlosť reakcie je nezávislá od koncentrácie B, pretože jej zvýšenie ju neovplyvňuje. Preto poradie reakcie vzhľadom na činidlo B je nula.
Na druhej strane porovnanie reakcií 4 a 1 umožňuje nasledujúce závery:
6 x 10-4 M · min-1 / 3 x 10-4 M · min-1 = 2
Medzitým sa pomer medzi [a] reakciami 4 a 1 sa rovná:
Môže vám slúžiť: 5 charakteristík homogénnych zmesí(0.20 mol / l) / (0.10 mol/l) = 2X
Potom bude vzťah medzi rozmermi:
2 = 2X
x = 1
Preto je vyjadrenie zákona o rýchlosti:
Rýchlosť reakcie = k · [a]
B sa nezoberie, pretože jej poradie reakcie je nulové.
Výpočet k
Môžeme vypočítať rýchlostnú konštantu z ktoréhokoľvek z kinetických údajov. Použime experiment 1:
K = rýchlosť reakcie / [a]
= 3 x 10-4 M · min-1 / 0.10 m
= 3 x 10-3 alebo 0.003 min-1
Cvičenie 2
Údaje o reakčnej rýchlosti sa získali pri určitej teplote.
2 CLO2 (ac) +2 oh- (AC) → CLO3- (ac) +clo2 (Ac) +h2Alebo (l)
Výpočty reakčných príkazov
Experimentálne údaje sú:
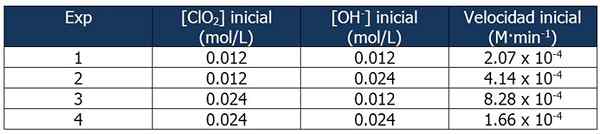 Cinetické údaje o cvičení 2. Zdroj: Gabriel Bolívar.
Cinetické údaje o cvičení 2. Zdroj: Gabriel Bolívar. Podiel medzi rýchlosťami reakcie 2 a reakciou 1 je:
4.14 x 10-4 M · min-1 / 2.07 x 10-4 M · min-1 = 2
A podiel koncentrácií OH- Medzi reakciami 2 a 1 sa rovná:
(0,024 mol/l)/(0,012 mol/l) = 2X
Exponent „x“ predstavuje poradie reakcie vzhľadom na OH činidlá-. Vzťah medzi vypočítanými rozmermi môže byť reprezentovaný takto:
2 = 2X
x = 1
Preto poradie reakcie vzhľadom na OH činidlo- sa rovná 1.
V reakcii 3 sa koncentrácia CLO zdvojnásobí2 reakcie 1, zatiaľ čo koncentrácia OH- Zostáva konštantný.
Podiel medzi rýchlosťami reakcií 3 a 1:
(8.28 x 10-4 M · min-1) / (2.07 x 10-4 M · min-1) = 4 (22)
A podiel [clo2] Medzi reakciami 3 a 1 sa rovná:
(0,024 mol/l)/(0,012 mol/l) = 2a
Exponent 'a' predstavuje poradie reakcie týkajúceho sa činidla CLO2.
Porovnanie rozmerov:
22 = 2a
4 = 2a
y = 2
Preto je reakcia druhá vzhľadom na činidlo CLO2.
Vyjadrenie zákona o rýchlosti bude potom:
Rýchlosť reakcie = k · [CLO2]2· [Oh-]
Výpočet k
Opäť môžeme vypočítať k z predchádzajúceho výrazu pomocou niektorého z kinetických údajov pre experimenty. Použijeme experiment 3:
K = (8.28 x 10-4 M · min-1) / (0.024 m)2 (0.012 m)
= 119.79 min-1· M-2
Odkazy
- Whitten, Davis, Peck & Stanley. (2008). Chémia. (8. vydanie.). Učenie sa.
- Wikipedia. (2020). Reakčná rýchlosť konštanty. Zdroj: In.Wikipedia.orgán
- Chémia Texas A&M University. (s.F.). Kinetika: výpočty vzorkovacieho frekvencie. Získané z: Chem.tama.Edu
- Keith J. Ležiaci. (2020). Reakčná rýchlosť. Encyclopaedia Britannica. Získané z: Britannica.com
- HelMestine, Anne Marie, PH.D. (25. augusta 2020). Aká je rýchlostná konštanta v chémii? Zotavené z: Thoughtco.com
- Clark Jim. (2013). Rýchlostné konštanty a Arrheniusova rovnica. Získané z: Chemguide.co.Uk

