Organické zlúčeniny

- 967
- 157
- Adrián Fajnor
Vysvetľujeme, aké organické zlúčeniny sú, ich charakteristiky, typy, ktoré sú, rozdiely s anorganickými zlúčeninami a uvádzajú niekoľko príkladov
 Organické zlúčeniny pochádzajú z živých bytostí
Organické zlúčeniny pochádzajú z živých bytostí Čo sú organické zlúčeniny?
Ten Organické zlúčeniny Sú to tie, ktoré pochádzajú z živých bytostí a obsahujú atómy uhlíka a vodíka spojené so sebou vo forme otvorených reťazcov alebo uzavretých cyklov.
Okrem uhlíka a vodíka môžu organické zlúčeniny obsahovať aj ďalšie prvky, ako je kyslík (O), dusík (N), síra (S), fosfor (P), fluór (F), chlór (Cl), bróm (BR) alebo jód (i). Všetky sa nazývajú heteroátomos.
Život by nebol možný bez organických zlúčenín, takže ich všetky živé bytosti obsahujú. Existujú tisíce týchto látok a my ich môžeme nájsť všade, počnúc vlastnými telami.
Charakteristiky organických zlúčenín
Sú založené na chémii uhlíka
Uhlík tvorí základ všetkých organických zlúčenín. V týchto zlúčeninách môžu byť atómy uhlíka navzájom spojené alebo s inými prvkami. Každý atóm uhlíka vždy tvorí celkovo 4 väzby, medzi jednoduchými, dvojitými a trojitými väzbami.
Majú kovalentné odkazy
Existujú tri typy hlavných chemických väzieb, ktoré sú kovalentné, iónové a kovové väzby. Organické zlúčeniny sa vyznačujú vlastnením iba kovalentných väzieb medzi všetkými ich atómami.
Sú to palivá
 Uhlík je palivo, ktoré sa získa z organických zlúčenín prítomných v dreve
Uhlík je palivo, ktoré sa získa z organických zlúčenín prítomných v dreve Obsahujúcim toľko atómov uhlíka sú organické zlúčeniny horľavé. To znamená, že môžu horieť pomocou spaľovacej reakcie s kyslíkom vzduchu.
Spaľovacie reakcie organických zlúčenín sú exotermické reakcie, ktoré uvoľňujú veľmi teplo. Všetky živé bytosti využívajú všetku túto energiu na vykonávanie všetkých reakcií, ktoré nás udržujú nažive.
Majú izomériu
Mnoho organických zlúčenín má rovnaký molekulárny vzorec, ale sú to úplne odlišné zlúčeniny. Táto vlastnosť sa nazýva Isomeía a je charakteristická pre organické zlúčeniny.
Napríklad obidva metrolické etanolové etanol majú molekulárny vzorec C2H6Alebo, ale prvý je plyn, zatiaľ čo druhá je tekutina.
Môžu tvoriť polyméry
Ďalšou charakteristikou organických zlúčenín je to, že môžu vytvárať gigantické molekuly opakujúce sa skupina atómov znova a znova v dlhom reťazci. Tieto zlúčeniny sa nazývajú polyméry a typickým príkladom sú plasty.
Rozpustnosť
Ďalšou vlastnosťou, ktorá charakterizuje organické zlúčeniny, je ich rozpustnosť. Mnohé z nich, najmä polárne organické zlúčeniny, sú rozpustné vo vode. Ostatné zlúčeniny sa nerozpúšťajú vo vode, ale v organických rozpúšťadlách, ako je cyklohexan.
Môže vám slúžiť: kyselina sukcinová: štruktúra, vlastnosti, získanie, použitiaTypy organických zlúčenín
Organické zlúčeniny majú vlastnosti a vlastnosti, vďaka ktorým sú veľmi odlišné od anorganických zlúčenín (tie, ktoré nepochádzajú zo živých bytostí, ako sú minerály).
Mnohé z týchto charakteristík im umožňujú klasifikovať ich rôznymi spôsobmi, čo vedie k rôznym typom organických zlúčenín. Najdôležitejšie kritériá klasifikácie sú:
- Podľa jeho pôvodu.
- Podľa jej štruktúry a zloženia.
- Podľa funkčnej skupiny.
- Podľa jeho polarity.
Ďalej sú opísané typy organických zlúčenín klasifikovaných podľa každého z týchto kritérií:
Typy organických zlúčenín podľa ich pôvodu
Ak pochádzajú, organické zlúčeniny môžu byť:
- Prírodné organické zlúčeniny: Sú to tí, ktorí sa nachádzajú v prírode a ktoré pochádzajú priamo z živých bytostí. Celulóza je dobrým príkladom, pretože je najhojnejšou prírodnou organickou zlúčeninou na Zemi.
- Syntetické organické zlúčeniny: Poukazujú na tie organické zlúčeniny, ktoré sú syntetizované chemikáliami v laboratóriu alebo v chemickom rastline. Všetky plasty, ktoré používame denne, sú syntetické a tiež veľa liekov.
Typy organických zlúčenín podľa ich štruktúry a zloženia
Podľa atómov, ktoré ich tvoria, a spôsob, akým sú tieto atómy spojené spolu, môžu byť organické zlúčeniny:
- Alifatické uhľovodíky: tvorené iba uhlíkom a vodíkom a kde uhlíky tvoria otvorené reťazce buď lineárne alebo rozvetvené. Zahŕňajú Alquenos a Alkines.
- Aromatické uhľovodíky: Zlúčeniny, ktoré patria do tejto rodiny, tiež nazývané piesky, obsahujú nenasýtené cykly (ktoré môžu mať stále viac vodíka), ktoré majú veľkú molekulárnu stabilitu. Táto vlastnosť sa nazýva aromaticita a je charakteristická pre benzén a všetky jeho deriváty.
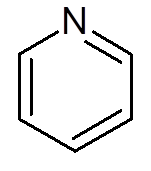
- Heterocyklické zlúčeniny: Sú to cyklické zlúčeniny, v ktorých sa jeden alebo viac atómov uhlíka nahradí heteroátomo, ktorým môže byť kyslík, dusík, síra alebo fosforus. Príkladmi heterocyklov sú pyridín a furano.
- Organometalické zlúčeniny: Sú to špeciálna trieda zlúčenín, ktoré sú na polceste medzi organickými a anorganickými. Sa vyznačujú obsahom organickej časti s heteroátom.
Typy organických zlúčenín podľa funkčnej skupiny
Časť organickej molekuly, kde sa zvyčajne vyskytujú chemické reakcie, je malá skupina atómov nazývaných funkčná skupina. Existuje niekoľko rôznych funkčných skupín, ktoré umožňujú klasifikáciu organických zlúčenín v:
- Zatvoriť: Obsahujú iba uhlík a vodík spojený iba jednoduchými väzbami. Napríklad bután.
- Alkény: Sú to uhľovodíky, ktoré obsahujú väzbu s dvojitým uhlíkom a uhlíkom. Napríklad buuténa.
- Alkíny: Sú to uhľovodíky, ktoré obsahujú trojuholníkovú väzbu z uhlíka. Napríklad Etino, tiež známy ako acetylén.
- Alkyl halogenuróz: Organické zlúčeniny obsahujúce halogén (F, Cl, BR alebo I) spojené s alifatickým uhlíkom. Napríklad chlórometán.
- Alkoholy: Alkoholy sú polárne organické zlúčeniny obsahujúce hydroxylovú skupinu (-OH) spolu s alifatickým uhlíkom.
- Fenoly: Tieto zlúčeniny obsahujú tiež hydroxylovú skupinu (-OH), ale v tomto prípade spolu s aromatickým uhlíkom.
- Éter: Ľahko sa rozpoznávajú, pretože sú to dva reťazce uhlíka spolu so sebou atómou kyslíka. Napríklad metyléter.
- Amín: Sú to organické zlúčeniny odvodené z amoniaku (NH3). Obsahujú jeden alebo viac alifatických uhlíkov (alkylových skupín) spojených s atómom dusíka pomocou jednoduchých väzieb.
- Aldehydy: Oxygenované organické zlúčeniny obsahujúce karbonylovú skupinu (C = O) spolu s vodíkom v jednom z jeho terminálnych uhlíkov. Všeobecne majú charakteristické pachy, ako napríklad cinamaldehyd, ktorý dáva vôňu škorice.
- Ketóny: Sú to okysličené organické zlúčeniny obsahujúce karbonylovú skupinu (C = O) spolu s dvoma uhlíkovými reťazcami.
- Karboxylové kyseliny: Tiež nazývané organické kyseliny sú to slabé kyseliny, ktoré obsahujú karboxylovú skupinu (-coOH) v jednom z jeho terminálnych uhlíkov.
- Estery: Pochádzajú z spojenia kyseliny karboxylovej s alkoholom. V tomto prípade je vodík karboxylovej skupiny nahradený požičovňou skupinou.
- Amidas: Pochádzajú z spojenia kyseliny karboxylovej s amínom. V tomto prípade je OH karboxylovej skupiny nahradená dusíkom pripojeným k dvom vodíkom, vodíkom a alkylom alebo dvoma alkálami.
Typy organických zlúčenín podľa ich polarity
Môžeme tiež klasifikovať organické zlúčeniny do polárnych a apolar:
- Polárne organické zlúčeniny: Tieto zlúčeniny majú polárne kovalentné väzby s atómami, ako je dusík a kyslík, ktoré vytvárajú celú molekulu polárnu. Väčšina z týchto zlúčenín je rozpustná vo vode.
- Apolárne organické zlúčeniny: Sú to tí, ktorí nemajú polárne odkazy alebo polarity ich odkazov sú navzájom zrušené. Tieto zlúčeniny nie sú rozpustné vo vode.
Rozdiely medzi organickými zlúčeninami a anorganickými zlúčeninami
Nasledujúca tabuľka sumarizuje rozdiely medzi organickými a anorganickými zlúčeninami:
Organické zlúčeniny | Anorganické zlúčeniny | |
Pôvod: | Pochádzajú z živých bytostí alebo ich pozostatkov. | Nepochádzajú z živých bytostí. |
Kompozícia: | Tvorené takmer výlučne C, N, O, S, P, F, Cl, BR a I. | Môžu byť tvorené ktorýmkoľvek prvkom periodickej tabuľky. |
Typy odkazov: | Tvoria kovalentné väzby polárne aj apolar. | Môžu tvoriť všetky typy chemických väzieb vrátane polárnych, apolárnych, iónových alebo kovových kovalentných väzieb. |
Izomery: | Väčšina súčasných Isomeía. | Iba niektoré súčasné Isomeía. |
Palivá: | Sú to palivá. | Väčšina z nich nie je horľavá. |
Príklady organických zlúčenín
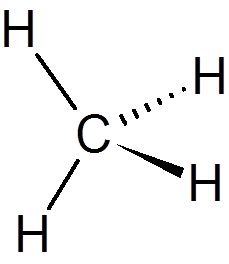
1. Metán (CH4)
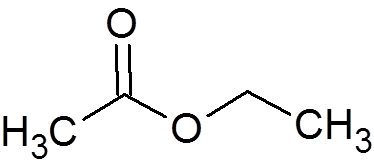
2. Etylacetát (c4H8Ani2)
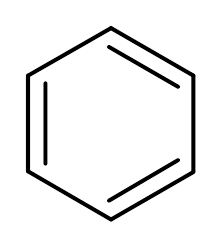
3. Benzén (c6H6)
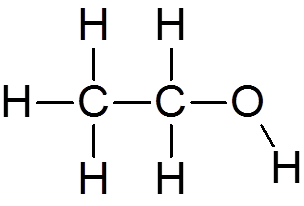
4. Etylalkohol (c2H6Buď)
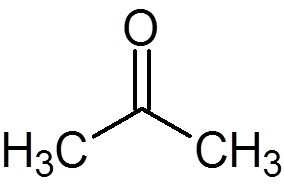
5. Acetón (c3H6Buď)
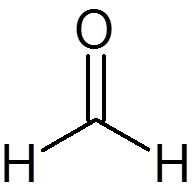
6. Formaldehyd (ch2Buď)
7. Hemoglobín (proteín)
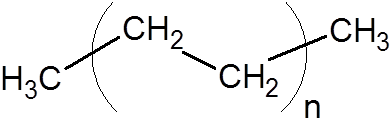
8. Polyetylén (jedna z najbežnejších plastov)
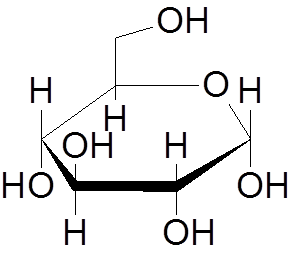
9. Glukóza (c6H12Ani6)
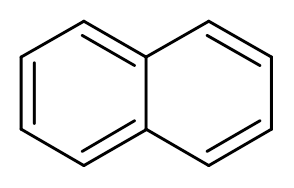
10. Naftalén (c10H8)
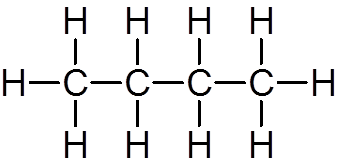
jedenásť. Butano (c4H10)
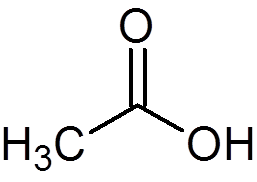
12. Kyselina octová alebo ocot (c2H4Ani2)
13. Neopentano (c5H12)
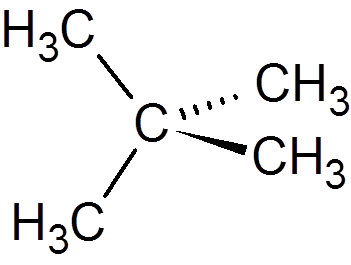
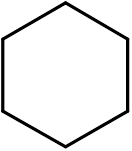
14. Cyklohexan (c6H12)
pätnásť. Pyridín (c5H5N)
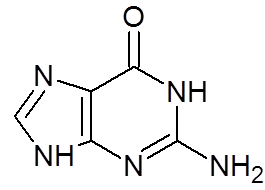
16. Guanina (c5H5N5Buď)
17. Fruktóza (c6H12Ani6)
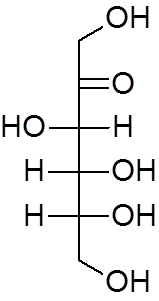
18. Etyléter (c4H10Buď)
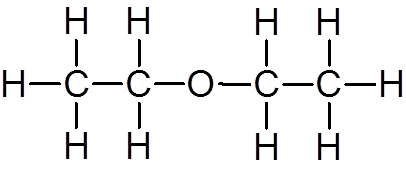
19. Metanol (CH4Buď)
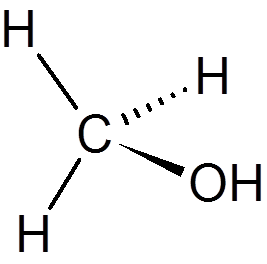
dvadsať. Chloroform (CHCL3)
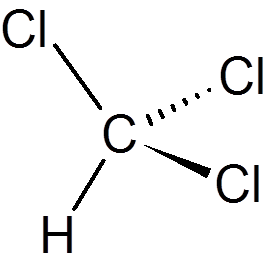
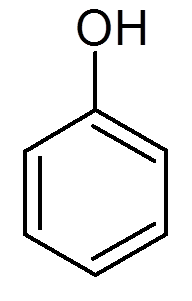
dvadsaťjeden. Fenol (c6H6Buď)
22. Acetylén (c2H2)
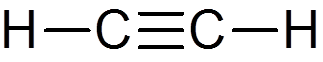
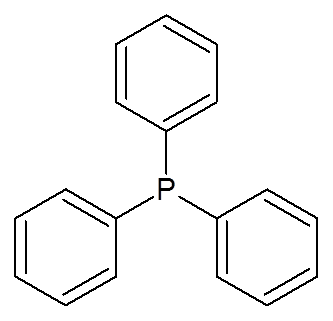
23. Trifenylfosfín (c (c6H6)3P)
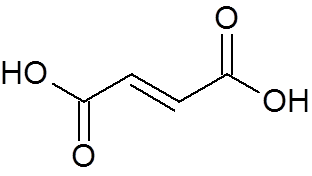
24. Kyselina transmbuteodioová (C4H4Ani4)
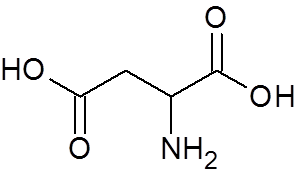
25. Kyselina asparágová (aminokyselina) (C4H7Nie4)
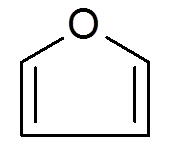
26. Furano (c4H4Buď)
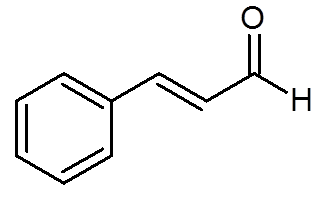
27. Cinamaldehyd (aróma škorice) (C9H8Buď)
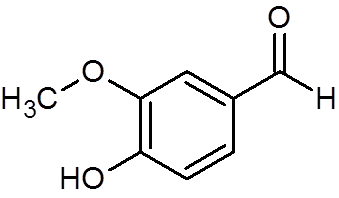
28. Vaniline (c8H8Ani3)
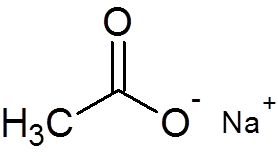
29. Octat sodný (c2H3Ani2Na)
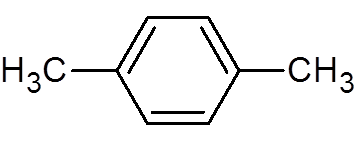
30. P-xylén (C8H10)
Odkazy
- Carey, f., & Giuliano, R. (2013). Organic Chemistry, 9. vydanie (9. vydanie.). New York, New York: McGraw-Hill Education.
- Hrad a., M. G. (s.F.). Hlavné triedy organických zlúčenín a funkčných skupín. Zotavené z UAEH.Edu.mx
- Chang, R., & Goldsby, K. Do. (2012). Chémia, 11. vydanie (11. vydanie.). New York, New York: McGraw-Hill Education.
- Klein, D. R. (2011). Organická chémia (1.do edimatizovať.). Hoboken, New Jersey: Wiley.
- Morrison, r. Tón., & Boyd, r. N. (2003). Organická chémia (6. vydanie.). Boston, Massachusets: Allyn & Bacon.

