Štruktúra chloridu medi (I) (CUCL), vlastnosti, použitia
- 2599
- 550
- MUDr. Miloslav Habšuda
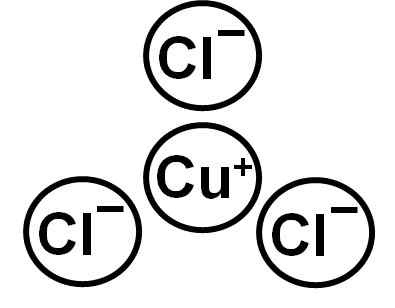
On chlorid medi (I) Je to anorganická zlúčenina tvorená meďou (Cu) a chlórom (Cl). Jeho chemický vzorec je CUCL. Meď v tejto zlúčenine má Valencia +1 a chlór -1. Je to biela kryštalická tuhá látka, ktorá pri vystavení dlhej dobe vo vzduchu získa zelenkavú sfarbenie kvôli oxidácii medi (I) do meďnatého (II).
Správa sa ako Lewisová kyselina, ktorá potrebuje elektróny iných zlúčenín, ktoré sú lewisovými základňami, s ktorými tvoria komplexné alebo stabilné adukty. Jednou z týchto zlúčenín je oxid uhoľnatý (CO), takže schopnosť spájať sa medzi nimi sa používa priemyselne na extrahovanie CO nealkoholických nápojov.
 Chlorid meďnatého (I) (CUCL) Purifikovaný. Leiem/CC BY-SA (https: // creativeCommons.Org/licencie/By-SA/4.0). Zdroj: Wikimedia Commons.
Chlorid meďnatého (I) (CUCL) Purifikovaný. Leiem/CC BY-SA (https: // creativeCommons.Org/licencie/By-SA/4.0). Zdroj: Wikimedia Commons. Má optické vlastnosti, ktoré sa dajú použiť v polovodičoch emitujúce svetlo. Nanokuby CUCL majú navyše veľký potenciál na použitie v efektívnych energetických zariadeniach.
Používa sa v umení pyrotechniky, pretože v kontakte s plameňom vytvára moderné zelené svetlo.
[TOC]
Štruktúra
CUCL tvorí ión Cuproso Cup Ion+ a anión chlorid cl-. Elektronická konfigurácia iónov Cu+ je:
1s2 2s2 2 P6 3s2 3p6 3D10 4s0
A je to preto, že meď stratila elektrón vrstvy 4S. Ión chloridu má konfiguráciu:
1s2 2s2 2 P6 3s2 3p6
Je zrejmé, že oba ióny majú svoje úplné elektronické vrstvy.
Táto zlúčenina kryštalizuje kubická symetria. Na obrázku nižšie sa pozoruje usporiadanie atómov v kryštalickej jednotke. Ružové gule zodpovedajú meďnej a zelenej gule chlóru.
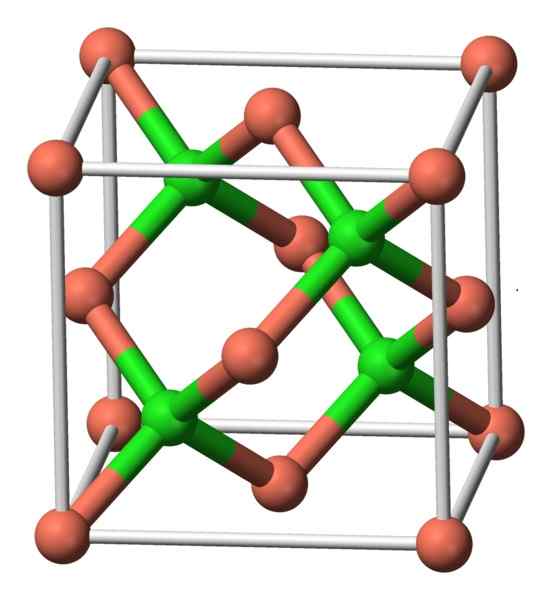 Konštrukcia CUCL. Autor: Benjah-Bmm27. Zdroj: Wikimedia Commons.
Konštrukcia CUCL. Autor: Benjah-Bmm27. Zdroj: Wikimedia Commons. Menovanie
- Chlorid medi (I)
- Chlorid
- Monoklorid medi
Vlastnosti
Fyzický stav
Kryštalická biela tuhá látka, ktorá je v predĺženom vzduchu so vzduchom oxidovaná a otočí sa.
Molekulová hmotnosť
98,99 g/mol
Bod topenia
430 ° C
Bod varu
Približne 1400 ° C.
Hustota
4 137 g/cm3
Rozpustnosť
Takmer nerozpustné vo vode: 0,0047 g/100 g vody pri 20 ° C. Nerozpustný v etanole (c2H5Oh) a acetón (vyberte3(C = o) ch3).
Môže vám slúžiť: Alilo: alyická jednotka, karbocation, radikálne, príkladyChemické vlastnosti
Je nestabilný vo vzduchu, pretože cu+ má tendenciu oxidovať Cu2+. V priebehu času, oxid Cupric (Cuo), cuprus hydroxid (CUOH) alebo komplexný oxychlorid a soľ sa stane zelenou farbou.
 Chlorid medi (I), ktorý bol vystavený životnému prostrediu a čiastočne oxidovaný. CUOH, CUOH a ďalšie zlúčeniny môžu obsahovať. Benjah-Bmm27 / verejná doména. Zdroj: Wikimedia Commons.
Chlorid medi (I), ktorý bol vystavený životnému prostrediu a čiastočne oxidovaný. CUOH, CUOH a ďalšie zlúčeniny môžu obsahovať. Benjah-Bmm27 / verejná doména. Zdroj: Wikimedia Commons. Vo vodnom roztoku je tiež nestabilný, pretože k oxidácii a redukčnej reakcii dochádza súčasne, tvoriaca kovový ión medi a medi (II):
CUCL → Cu0 + Cucl2
CUCL ako Lewisová kyselina
Táto zlúčenina pôsobí chemicky ako kyselina Lewis, čo znamená, že túži po elektronoch, takže tvorí stabilné adukty so zlúčeninami, ktoré im môžu poskytnúť.
Je veľmi rozpustný v kyseline chlorovodíkovej (HCL), kde CL ióny- Správajú sa ako elektrónové darcovia a tvoria sa druhy ako CUCL2-, Cucl32- a cu2Cl42-, okrem iného.
 Toto je jeden z druhov, ktoré sa tvoria v roztokoch CUCL v HCL. Autor: Marilú Stea.
Toto je jeden z druhov, ktoré sa tvoria v roztokoch CUCL v HCL. Autor: Marilú Stea. Vodné roztoky CUCL majú schopnosť absorbovať oxid uhoľnatý (CO). Táto absorpcia sa môže vyskytnúť, keď sú tieto roztoky kyslé aj neutrálne alebo s amoniakom (NH3).
V takýchto roztokoch sa odhaduje, že sa vytvárajú rôzne druhy, ako je Cu (CO)+, Kukučka)3+, Kukučka)4+, CUCL (CO) a [CU (CO) CL2]-, čo závisí od média.
Ďalšie vlastnosti
Má elektrooptické charakteristiky, nízku optickú stratu v širokom rozsahu svetelného spektra od viditeľného po infračervený index s nízkym refrakciou a konštantný dielektrický nízky.
Získanie
Chlorid meďnatého (I) sa dá získať reakciou kovovej meďnej priamo s plynným chlórom pri teplote 450-900 ° C. Táto reakcia sa uplatňuje priemyselne.
2 cu + cl2 → 2 CUCL
Môžete tiež použiť redukčnú zlúčeninu, ako je kyselina askorbová alebo oxid siričitý, na prejdenie chloridu meďnatého (II) do chloridu medi (I). Napríklad v prípade SO2, Toto je oxidované na kyselinu sírovú.
2 CUCL2 + SW2 + 2 h2O → 2 CUCL + H2SW4 + 2 HCl
Žiadosti
V procesoch recovery
Schopnosť absorbujúcich a insorberových roztokov.
Môže vám slúžiť: turbidimetriaNapríklad proces nazývaný Cosorb používa stabilizovaný chlorid medi vo forme komplexnej soli s hliníkom (AnyCl4), ktorý sa rozpúšťa v aromatickom rozpúšťadle, ako je toluén.
Roztok absorbuje CO plynného prúdu na jeho oddelenie od iných plynov, ako je CO2, N2 a Ch4. Potom je roztok bohatý na oxid zahrievaný pri zníženom tlaku (tj nižší ako atmosférický) a CO je exorg. Plyn obnovený týmto spôsobom je vysoká čistota.
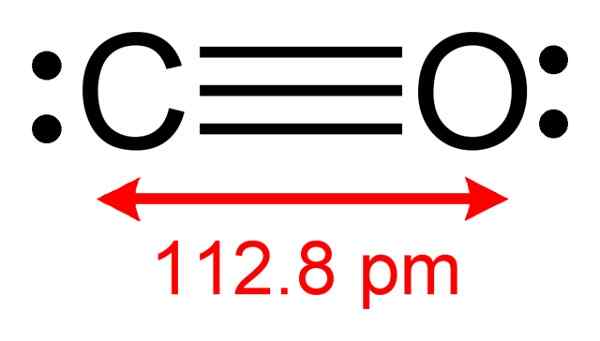 Štruktúra oxidu uhoľnatého, kde sú pozorované elektróny, ktoré sú k dispozícii na vytvorenie komplexu s CUCL. Autor: Benjah-Bmm27. Zdroj: Wikimedia Commons.
Štruktúra oxidu uhoľnatého, kde sú pozorované elektróny, ktoré sú k dispozícii na vytvorenie komplexu s CUCL. Autor: Benjah-Bmm27. Zdroj: Wikimedia Commons. Tento proces vám umožňuje získať čistú co.
Pri katalýze
CUCL sa používa ako katalyzátor pre rôzne chemické reakcie.
Napríklad reakcia prvku Germanio (GE) s chloridom vodíka (HCI) a etylénom (CH2= CH2) sa dá vykonať pomocou tejto zlúčeniny. Slúži tiež na syntézu organických kremíkových zlúčenín a meniacich sa heterocyklických organických derivátov síry a dusíka.
Môžete syntetizovať polymér polyfenilenetu pomocou katalytického systému 4-aypírínu a squattingu. Tento polymér je veľmi užitočný pre jeho mechanické vlastnosti, malú absorpciu vlhkosti, vynikajúcu izoláciu elektrickej energie a odpor proti požiaru.
Pri získavaní organických medených zlúčenín
Alkenilcupratato zlúčeniny sa môžu pripraviť reagovaním na terminálne alky.
Pri získavaní polymérov zjednotených s kovmi
Chlorid medi (I) sa môže koordinovať s polymérmi tvoriacimi komplexné molekuly, ktoré slúžia ako katalyzátory a ktoré kombinujú jednoduchosť heterogénneho katalyzátora s pravidelnosťou homogénnej.
V polovodičoch
Táto zlúčenina sa používa pri získavaní materiálu tvoreného y-corpu na kremíku.
Tieto materiály majú široké použitie v ultrafialových diódach emitujúceho svetla, laserové diódy a detektory svetla.
Môže vám slúžiť: bromid draselný (KBR): Štruktúra, vlastnosti, použitiaV Super CardPisors
Tento produkt získaný vo forme kubických alebo nanočastíc nanočastíc umožňuje vyrábať Supercaders, pretože má vynikajúcu rýchlosť zaťaženia, vysokú reverzibilitu a malú stratu kapacity.
Superkordéry sú zariadenia na ukladanie energie, ktoré vynikajú pre svoju vysokú hustotu výkonu, prevádzku v prevádzke, rýchle zaťaženie a výbojové cykly, dlhodobá stabilita a sú šetrné k životnému prostrediu.
 Nanocubos CUCL by sa mohol použiť v aplikáciách elektroniky a ukladania energie. Autor: príliv. Zdroj: Pixabay.
Nanocubos CUCL by sa mohol použiť v aplikáciách elektroniky a ukladania energie. Autor: príliv. Zdroj: Pixabay. Ostatné aplikácie
Poskytnúť.
 Zelená farba niektorých ohňostrojov môže byť spôsobená chrápaním. Autor: Hans Braxmeier. Zdroj: Pixabay.
Zelená farba niektorých ohňostrojov môže byť spôsobená chrápaním. Autor: Hans Braxmeier. Zdroj: Pixabay. Odkazy
- Milek, J.Tón. a Neuberger, m. (1972). Chlorid. In: Lineárne elektrooptické modulárne materiály. Springer, Boston, MA. Odkaz obnovený.Prubár.com.
- Olovo, D.R. (Editor) (2003). Príručka chémie a fyziky CRC. 85th CRC Press.
- Sneeden, r.P.Do. (1982). Metódy absorpcie/disorpcie. V komplexnej organometalickej chémii. Zväzok 8. Zotavené z vedeckých pracovníkov.com.
- Bavlna, f. Albert a Wilkinson, Geoffrey. (1980). Pokročilá anorganická chémia. Štvrté vydanie. John Wiley & Sons.
- Chandrashekhar, V.C. a kol. (2018). Nedávny pokrok v priamej syntéze organometových a koordinačných zlúčenín. V priamej syntéze kovových komplexov. Zotavené z vedeckých pracovníkov.com.
- Kyushin, s. (2016). Syntéza organosilikónu na konštrukciu organosilikónových zhlukov. V účinných metódach prípravy kremíkových zlúčenín. Zotavené z vedeckých pracovníkov.com.
- Van Koten, G. a Noltes, J.G. (1982). Zlúčeniny. V komplexnej organometalickej chémii. Zväzok 2. Zotavené z vedeckých pracovníkov.com.
- Danieluk, D. a kol. (2009). Optické vlastnosti nedopedných a kyslíkových klenotových filmov na kremík. J Mater Sci: Mater Electron (2009) 20: 76-80. Odkaz obnovený.Prubár.com.
- Jin, b. a kol. (2014). Nanočasy chloridu pestované na zlyhaní medi pre pseudokapacitorové elektródy. Nano-mikro Lett. 6, 340-346 (2014). Odkaz obnovený.Prubár.com.
- Kim, K. a kol. (2018). Vysoko účinný aromatický amínový ligand/meď (I) chlorid. Polymers 2018, 10, 350. MDPI sa zotavila.com.
- Wikipedia (2020). Meď (i) chlorid. Získaný z.Wikipedia.orgán.
- « Molárna frakcia Ako sa vypočítava, príklady, cvičenia
- Butyrický získanie tuku, typy, zloženie, použitie, výhody »

