Chlorid vápenatý (CACL2)
- 4816
- 144
- Denis Škriniar
Vysvetľujeme, čo chlorid vápenatého, jeho štruktúra, fyzikálne a chemické vlastnosti, ako sa syntetizuje a jeho aplikácie sú
Čo je chlorid vápenatého?
On chlorid vápenatý (CACL2) Je to anorganická soľ zložená z vápnika, alkalického kovu a halogénového chlóru. V tejto zlúčenine existuje niekoľko elektrostatických interakcií, ktoré definujú vonkajší vzhľad ich kryštálov a zvyšok jeho fyzikálnych vlastností.
Je tiež sprevádzaný molekulami vody, čím sa vytvára hydraty všeobecného vzorca COCL2· Xh2Alebo s x = 0, 1, 2, 4 a 6. Keď x = 0, soľ chýba voda a je nekologená, ako je to uvedené vyššie uvedeným chemickým vzorcom.
Na vynikajúcom obrázku sú znázornené niektoré pevné časti CACL2. V podmienkach malej vlhkosti je to možné.
Vzorec
Jeho chemický vzorec je CACL2: Vyjadruje to pre každý ión Ca Ion2+ Existujú dva ióny CL- ktoré neutralizujú kladné zaťaženie. Vápnikový kov -skupina 2 periodickej tabuľky (SR. Scholambara)- poskytuje svoje dva elektróny každému atómu chlóru, skupinový prvok 17.
Štruktúra chloridu vápenatého
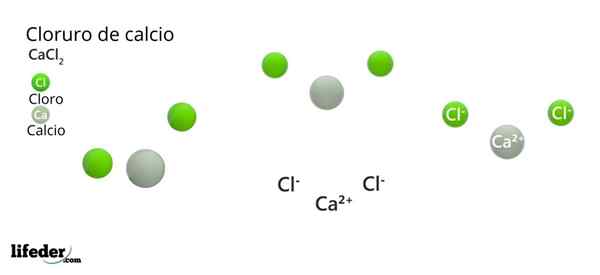
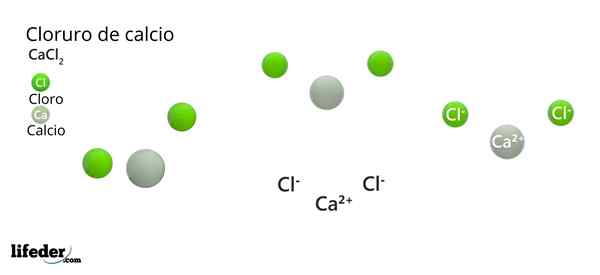
Na vynikajúcom obrázku je ilustrovaná štruktúra CACL2 anhydrid. Zelené gule zodpovedajú iónom CL-, Zatiaľ čo biele pre ióny ca2+. Tieto sféry sú fixované v paralepipite, čo nie je nič iné ako jednotná ortombická bunka kryštálov.
Štruktúra môže poskytnúť falošnú myšlienku, ktorú prevažuje vápnik; Ak sa však reprodukuje viac opakovaní jednotkovej bunky, najväčšie množstvo zelených guľôčok by bolo jasné: CL ióny-.
Na druhej strane ióny CA2+ Majú menšie iónové rádiá ako CL ióny-. Je to preto, že keď stratia elektróny, jadrá atómov vyvíjajú väčšiu atraktívnu silu na vonkajšie elektronické vrstvy, čo znižuje iónový polomer.
V prípade CL-, To má ďalší elektrón, ktorý nemožno prilákať rovnakou silou, čím sa zvyšuje jeho iónový polomer.
Môže vám slúžiť: vodné roztokyMolekulárna geometria a vodné vápnikové komplexy
V strede paralelnepiped ca2+ Je obklopený šiestimi CL-. Štyri z nich ležia v štvorcovej rovine a ďalšie dve sa nachádzajú kolmo (najodľahlejšie zelené gule v bielej gule).
V dôsledku usporiadania týchto iónov, okolo CA2+ Octaedro je „zbraň“, čím priraďuje oktaedrálnu molekulárnu geometriu.
Vzhľadom na to, ako sú usporiadané zelené gule, môže nahradiť molekulu vody, ktorá sa vyskytuje s zdvihom2· H2Alebo možno v štvorcovej rovine. Táto skutočnosť modifikuje kryštalickú štruktúru a ako voda nahrádza zelené gule, usporiadanie iónov sa mení viac.
Keď všetky CL ióny- Sú nahradené molekulami vody, tvorí sa hydrát CACL2· 6h2Ani. V tomto bode je oktadron „vodný“ a molekuly sú teraz schopné interagovať medzi nimi vodíkovými mostmi (CA2+ Oh-h-oh2).
Vápnik môže akceptovať ešte viac molekúl vody bez zmeny stanoveného pomeru. To znamená, že CACL2· 6h2Alebo môže prijať ďalšie komplexné štruktúry do bodu zvažovania kryštalických polymérov vápnika a vody.
Tieto štruktúry sú však menej stabilné ako štruktúry postavené elektrostatickými interakciami (CA2+ a cl-) zo soli anhydridu.
Použitie/aplikácie chloridu vápenatého
Hlavné aplikácie chloridu vápenatého sú:
- Vyvarujte sa zamrznutiu vody počas zimy. Chlorid vápenatého vytvára pri rozpustení a potom zvyšuje teplotu, dochádza k fúzii ľadovej fúzie veľmi teplo. Z tohto dôvodu sa používa na zníženie rizika obehu ľudí a vozidiel počas studenej stanice.
- Pomôžte ovládať prach na nespevnených cestách.
- Po naliat.
- Kachľové tekutiny2 Účinnosť vŕtania pri extrakcii plynu z ich podzemných ložísk sa zvyšuje, ako aj ropa.
- Pridávajú sa bazény, aby sa znížila erózia, ktorú utrpel betón jeho stien. Sedimentovaný vápnik plní túto funkciu.
- Pretože ide o hygroskopickú soľ, chlorid vápenatého sa môže použiť ako disekt, ktorý je schopný znížiť vlhkosť okolitého vzduchu, a preto z látok v kontakte s týmto vzduchom.
- Používa sa ako konzervačný prostriedok v niektorých potravinách, ako aj v niekoľkých prídavkoch, napríklad v energetických nápojoch používaných športovcami, syrmi, pivami atď.
- V lekárskej praxi má tiež užitočnosť pri liečbe depresie spôsobenej predávkovaním síranu horečnatého, ako aj otravy olovom.
Syntéza chloridu vápenatého
Prírodné zdroje tejto zlúčeniny sú salmuera extrahované z morí alebo z jazier.
Jeho hlavný zdroj však pochádza z procesu Solvay, v ktorom vápenec (Caco3) trpí sériou transformácií, kým nie je odvodená z chloridu vápenatého produktu:
2NACL (aq) + caco3(s) na2Co3(s) + CACL2(Ac)
Produktom záujmu tohto procesu je v skutočnosti uhličitan sodný, NA2Co3.
Vlastnosti chloridu vápenatého
Fyzikálne vlastnosti a delikátne
Je to biela, toaleta a hygroskopická pevná látka. Táto tendencia absorbovať vlhkosť životného prostredia je spôsobená základnosťou CA iónov2+.
Základnosť toho, aký druh: Lewisa alebo Bronsteda? Lewis, pretože pozitívny druh je schopný prijať elektróny. Tieto elektróny sú darované napríklad atómami kyslíka molekúl vody.
Tuhá látka absorbuje vlhkosť do stupňa rozpustenia v tej istej vode, ktorá jej kryštály zveri. Táto vlastnosť je známa ako delikvicecencia.
Jeho hustota je 2,15 g/ml. Keďže do svojej štruktúry začleňuje vodu, kryštál je „rozšírený“, zvyšuje objem a následne znižuje hustotu. Iba CACL2· H2O Zlomenie s týmto trendom, ktorý ukazuje väčšiu hustotu (2,24 g/ml).
Molekulová hmotnosť anhydridnej soli je približne 111 g/mol a pre každú molekulu vody v jej štruktúre táto hmotnosť zvyšuje 18 jednotiek.
Rozpustnosť
CACL2 Je veľmi rozpustný vo vode a v niektorých polárnych rozpúšťadlách, ako je etanol, kyselina octová, metanol a iné alkoholy.
Ohrievanie
Keď sa proces rozpustí vo vode, je exotermický, a preto roztok a jeho okolie zahrieva roztok a jeho okolie.
Môže vám slúžiť: Odkiaľ pochádza plast? HistóriaJe to preto, že vodný komplex lepšie stabilizuje ióny CA2+ V roztoku, že elektrostatické interakcie s CL iónmi-. Keďže produkt je stabilnejší, pevná látka uvoľňuje energiu vo forme tepla.
Elektrolytický rozklad
CACL2 Roztavenie sa môže podrobiť elektrolýze, fyzikálnemu procesu, ktorý spočíva v separácii zlúčeniny v jej prvkoch od pôsobenia elektrického prúdu. V prípade tejto soli sú výrobkami kovový vápnik a plynný chlór:
Kacl2(L) → CA (s) + CL2g)
Ióny CA2+ Sú redukované v katóde, zatiaľ čo CL ióny- Sú oxidované v anóde.
Odkazy
- Wikipedia. (2018). Chlorid vápenatý. Získaný z.Wikipedia.orgán
- Triasť a Atkins. (2008). Anorganická chémia. V prvkoch skupiny 2. (Štvrté vydanie., p. 278). MC Graw Hill.
- Publikácia. (2018). Chlorid vápenatý. Obnovený z pubchem.Ncbi.NLM.NIH.Vláda.
- Oxychem. Chlorid vápenatý: Sprievodca fyzikálnymi vlastnosťami. Oxy obnovený.com
- Karole Ann. Bežné použitie chloridu vápenatého. Hunker sa uzdravil.com