Štruktúra chlorita sodného (NAClo2), vlastnosti, použitie, riziká

- 4864
- 38
- Tomáš Mydlo
On chlorit sodný Je to anorganická tuhá látka tvorená iónovou sodnou na+ a iónový chloritný clo2-. Jeho chemický vzorec je Naclo2. Je to kryštalická biela pevná látka, okrem toho, že je to silným oxidačným činidlom. Preto musí byť veľmi opatrný.
Jeho hlavné použitie je ako dezinfekčný agent pre mnoho aplikácií. Umožňuje eliminovať mikróby na povrchoch, ako sú podlahy, steny a laboratórne vybavenie v nemocniciach a klinikách a vo vodných systémoch.
 Chlorit sodný Naclo2 tuhý. AUTOR: Chemical Informácie . Zdroj: Wikimedia Commons.
Chlorit sodný Naclo2 tuhý. AUTOR: Chemical Informácie . Zdroj: Wikimedia Commons. Aj v poľnohospodárskych a veterinárnych zariadeniach, hygienizácia inkubátorov vtáčieho vajíčka, na kontrolu infekcií mliečnych kráv, dezinfekciu vodných systémov pre zvieratá atď.
V potravinárskom priemysle ich okyslené vodné roztoky podávajú na umývanie mäsa, kurčiat, ovocia, zeleniny, ako aj vybavenie takýchto zariadení.
Pri chlorite sodný je možné pripraviť oxid chloričitého2 Na mieste používania, ktorý vám umožňuje eliminovať mikróby, zlé zápach a príchute vody, aby bol príjemný a mohol piť bez problémov.
Medzi ďalšie aplikácie slúži tiež na bielenie papierovej buničiny, zeleninových textilných vlákien a olejov.
Naclo2 S tuhým sa musí zaobchádzať opatrne, pretože v kontakte s určitými výbuchmi materiálov sa môže vyskytnúť. Ich riešenia je trochu ľahšie manipulovať, ale sú veľmi oxidujúce a korozívne.
[TOC]
Štruktúra
Chlorit sodný je tvorený katiónom sodným+ a anión chloritný clo2- Preto sú zjednotení iónovým zväzkom.
Anión chlorita má atóm chlóru v oxidačnom stave +3 a dva atómy kyslíka s valencia -2. Z tohto dôvodu má chloritický anión negatívne bremeno.
Má tiež štruktúru uhol.
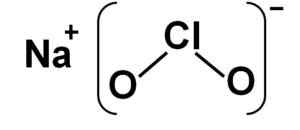 Štruktúra chlorita sodného NACLO2. Autor: Marilú Stea.
Štruktúra chlorita sodného NACLO2. Autor: Marilú Stea. Menovanie
- Chlorit sodný
- Chlorit sodný
- Chlór
Vlastnosti
Fyzický stav
Kryštalická biela pevná látka.
Molekulová hmotnosť
90,44 g/mol.
Bod topenia
Rozkladá sa, keď sa topí medzi 180 a 200 ° C.
Hustota
2 468 g/cm3
Rozpustnosť
Vodné rozpustné: 64 g/100 g vody pri 17 ° C. Mierne rozpustný v metanole.
Ďalšie vlastnosti
Je mierne hygroskopický.
Je to silné oxidačné činidlo. Násilne reaguje s horľavými materiálmi a reduktormi. Násilne reaguje s kyselinami a vytvára CLO chloričitého oxidu2.
Môže vám slúžiť: pravidlá Hume-RotheryJeho alkalické roztoky (to znamená v prítomnosti napríklad NaOH) sú pomerne stabilné, zatiaľ čo v kyslom médiu sa vytvára HCLO kyseliny chlóro2, Čo sa rýchlo rozkladá:
4 HCLO2 → 2 CLO2↑ + CLO3- + Cl- + 2 h+ + H2Ani
Riziká
Obidve Naclo2 Pevné, pretože ich vodné roztoky sú potenciálne nebezpečné a počas ich manipulácie a skladovania vyžadujú veľa opatrnosti a skúseností.
Naclo2 Pevná látka môže explodovať pri príchode do kontaktu s organickými látkami vrátane rukavíc a odevov, únikových materiálov, ako je pilina a odpadová bavlna, ako aj oleje a tuky.
Plná forma sa preto veľmi ťažko prepravuje a je uprednostňované ju používať vo forme vodných roztokov.
Tieto riešenia sú mimoriadne korozívne. Mali by sa najlepšie udržiavať pH nad 8, to znamená alkalické pH.
Naclo2 urýchľuje spaľovanie zlúčenín alebo horľavých materiálov do bodu, že s nimi môže tvoriť výbušné zmesi.
Ak sa zahrieva, emitujte toxické fajčenie kyseliny hydrochlorovodíkovej HCl a oxidu sodného Na2Ani. Ak je predĺžená predĺžená na ohrievanie alebo oheň, môže to využiť.
Získanie
Pripravuje sa začínajúc chemickou alebo elektrochemickou redukciou sodio naclo3, V prítomnosti kyseliny hydrochlorovodíkovej HCl za vzniku clo oxidu chloričitého2.
Ten reaguje s peroxidom vodíka H2Ani2 V vodnom roztoku hydroxidu sodného NaOH a roztoku sodného sodného sa získa2, ktorý odparuje a kryštalizuje pevnú látku.
Môže sa tiež získať prechodom plynným oxidom chloričitého2 Pre roztok NaOH.
2 CLO2 + 2 NaOH → Naclo2 + Naclo3 + H2Ani
Žiadosti
Ako mikrobicíd a dezinfekčný prostriedok vo viacerých aplikáciách
Je to zložka mnohých výrobkov, ktoré slúžia na kontrolu baktérií, húb a kalov alebo bahna rias. Výrobky, ktoré ho na tento účel obsahujú, sa používajú v poľnohospodárstve, obchode, priemysle a rezidenciách alebo domoch.
Slúži ako dezinfekčný prostriedok mnohých druhov materiálov a povrchov.
V poľnohospodárstve sú hydiny a podobné priemyselné odvetvia dezinfikované tvrdé povrchy, vybavenie, zariadenia na inkubáciu vtáčích vajíčok, skleníky pre huby, ako sú huby a chladiace vodné a vodné vodné systémy pre perá vtákov.
Má veterinárne použitie ako lokálny dezinfekčný prostriedok pri kontrole mastitídy mliekarenského hovädzieho dobytka, aby ponoril bradavky zvieraťa. Mastitída je infekcia kráv uders.
Môže vám slúžiť: Adiabatický proces: typy, príklady, vyriešené cvičenia Niekedy musíte ponoriť kravy do roztokov chlorita sodného, aby ste v nich zabránili infekciám. Autor: Hans Braxmeier. Zdroj: Pixabay.
Niekedy musíte ponoriť kravy do roztokov chlorita sodného, aby ste v nich zabránili infekciám. Autor: Hans Braxmeier. Zdroj: Pixabay. Používa sa tiež v prírodných výskumných zariadeniach na dekontamináciu laboratórií.
Komerčné, priemyselné a lekárske použitie zahŕňajú dezinfekčné ventilačné systémy, tvrdé povrchy (ako sú podlahy, steny, laboratórne vybavenie) a vodné systémy.
V zdravotníckych zariadeniach, ako sú kliniky a nemocnice.
Je tiež užitočný pre hygienizáciu v zariadeniach, v ktorých ľudia podliehajú liečbe vody alebo kúpeľov.
V potravinárskom priemysle sa používa ako fumigant na ochranu potravín.
Používa sa vo forme okysleného chlorita sodného. Vyrába sa pridaním kyseliny potravinového stupňa (napríklad kyselina citrónová, kyselina fosforečná, kyselina koleso alebo síran kyseliny sodný) do vodného roztoku chlorita sodného.
Acifikovaný chlorit sodný má antimikrobiálne vlastnosti a používa sa ako rosa alebo kuracie umývanie alebo namáčanie, mäso, zelenina, ovocie a morské výrobky. Tiež vo vode na zmrazenie kuracieho mäsa alebo vtákov.
V domácnostiach umožňuje dezinfikovať tvrdé povrchy, ako sú podlahy a kúpeľne, vykurovacie alebo klimatizačné systémy a systémy obehu vody v bazéne.
 Ak chcete dezinfikovať bazény, môžete použiť chlorit sodný Naclo2. Autor: Age Global Group. Zdroj: Pixabay.
Ak chcete dezinfikovať bazény, môžete použiť chlorit sodný Naclo2. Autor: Age Global Group. Zdroj: Pixabay.  Výrobky obsahujúce chlorit sodný umožňujú toaletné kúpeľne. Autor: Michal Jarmoluk. Zdroj: Pixabay.
Výrobky obsahujúce chlorit sodný umožňujú toaletné kúpeľne. Autor: Michal Jarmoluk. Zdroj: Pixabay. Predáva sa tiež v malých vreckách spolu s ďalšími zlúčeninami, aby sa uvoľňovali plyn a kontrolné zápachy v domácnostiach.
Dezinfikovať pitnú vodu
Používa sa pri čistení vody na pitie, pôsobí ako oxidant, zlepšuje chuť a vôňu pitnej vody.
Chlorón sodný sa široko používa ako predchodca na tvorbu oxidu chloričitého CLO2 ktorý slúži na liečbu pitnej vody na ľudskú spotrebu, tj na odstránenie mikroorganizmov, zápachov a nepríjemných chutí a môže piť.
Na generovanie CLO2 HCl je možné použiť:
5 NACLO2 + 4 HCl → 4 CLO2↑ + 5 NaCl + 2 h2Ani
Clo2 Je to antimikrobiálne činidlo s vysokým účinkom oxidantu a širokého spektra. To znamená, že koná proti veľkému počtu mikroorganizmov.
Môže vám slúžiť: draselný nitri (KNO2): Štruktúra, vlastnosti a použitiaMikroorganizmy sú deaktivované, pretože CLO2 interferuje s dôležitými enzýmami z nich a s proteínmi bunkových membrán. Má tiež výhodu, že nevytvára organochlórne zlúčeniny, ktoré sú toxické.
Na predaj sú tablety chlorita sodný zmiešané s inými zlúčeninami, ktoré sa rozpustia vo vode a okamžite produkujú CLO2 kontrolovaným spôsobom, a tým dezinfekcia vody.
 Chlorit sodný sa používa s inými zlúčeninami na získanie pitnej vody pripravenej na pitie. Autor: Ulrike Leone. Zdroj: Pixabay.
Chlorit sodný sa používa s inými zlúčeninami na získanie pitnej vody pripravenej na pitie. Autor: Ulrike Leone. Zdroj: Pixabay. Hlavný problém ošetrenia vody na odstránenie príchutí a vonia cez CLO2 Spočíva v tom, že toxický chlorit a solí chlóru sa môžu vytvoriť počas liečby.
Pre starostlivosť o kontaktné šošovky
Naclo2 Je súčasťou roztokov používaných na dezinfekciu kontaktných šošoviek.
Používa sa kombinácia NACLO2 a stopy (veľmi malé množstvá) peroxidu vodíka h2Ani2.
H2Ani2 Stabilizovať2 Tvoje sa a kombinácia oboch je veľmi účinná proti baktériám, húb a kvasinkách. Výrobky, ktoré sú potom chlorid sodný, voda a kyslík, ktoré sú neškodné, čo znamená, že nie sú škodlivé pre oko.
Keď sú šošovky odstránené z roztoku, NACLO2 Zvyškový rozklad rýchlo v Nall a O2. Zvyškový peroxid neznalýva okom. Preto sú tieto riešenia veľmi bezpečné.
 Roztoky na dezinfekciu kontaktných šošoviek majú medzi svojimi prísadami chlorirát sodný. Autor: Nieuw ~ commonswiki. Zdroj: Wikimedia Commons.
Roztoky na dezinfekciu kontaktných šošoviek majú medzi svojimi prísadami chlorirát sodný. Autor: Nieuw ~ commonswiki. Zdroj: Wikimedia Commons. V rôznych aplikáciách
Chlorón sodný sa používa na prípravu oxidu chloričitého2 na okamžité použitie vo veľkom počte aplikácií, z ktorých niektoré boli ošetrené v predchádzajúcich odsekoch.
Slúži na bielenie drevenej buničiny, textílií, ako sú bavlna, rastlinné vlákna, jedlé a nevedené oleje, tuky, laky, laky a vosky.
Je to súčasť očných kvapiek a niektorých roztokov pre orálne umývanie.
Používa sa v priemysle spracovania kože a v agentoch pre kovovú elektródu (kovový náter).
Odkazy
- Williams, L. a kol. (2019). Mikrobiológia, starostlivosť o šošovky a údržba. V kontaktných šošovkách (šieste vydanie). Zotavené z vedeckých pracovníkov.com.
- Alebo.Siež. Lekárska knižnica. (2019). Chlorit sodný. Obnovený z pubchem.Ncbi.NLM.NIH.Vláda.
- Gray, n.F. (2014). Oxid chloričitý. Technológia. V mikrobiológii chorôb prenášaných vodou (druhé vydanie). Zotavené z vedeckých pracovníkov.com.
- McKen, L. (2012). Úvod do potravín a lekárska sterilizácia. Oxid chloričitý. V účinku sterilizácie na plasty a elastoméry (tretie vydanie). Zotavené z vedeckých pracovníkov.com.
- Ortenberg, e. a Telsch, B. (2003). Problémy s chuťou a zápachom v pitnej vode. V mikrobiológii vody a odpadových vôd. Zotavené z vedeckých pracovníkov.com.
- Karsa, D.R. (2007). Biocídy. Oxid chloričitý. V príručke na čistenie/dekontamináciu povrchov. Zotavené z vedeckých pracovníkov.com.
- Bavlna, f. Albert a Wilkinson, Geoffrey. (1980). Pokročilá anorganická chémia. Štvrté vydanie. John Wiley & Sons.
- Ullmannova encyklopédia priemyselnej chémie. (1990). Piaty vydanie. VCH Verlagsgellschaft MBH.

