História cytochémie, objekt štúdie, užitočnosť a techniky
- 943
- 103
- MUDr. Miloslav Habšuda
Ten Cytochémia Zahŕňa sériu techník, ktoré sú založené na identifikácii a dispozícii určitých špecifických látok vo vnútri bunky. Považuje sa za vetvu bunkovej biológie, ktorá kombinuje morfológiu buniek s chemickou štruktúrou.
Podľa Bensleyho, zakladateľa aplikácie modernej cytologie, vyjadruje, že účelom cytochémie je objaviť chemickú organizáciu buniek s cieľom porozumieť tajomstvám života. Ako aj štúdium dynamických zmien, ktoré sa vyskytujú v rôznych funkčných fázach.
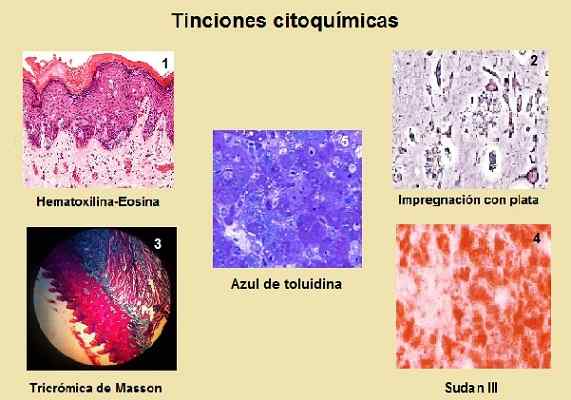
 1: Paget Extramamamaria Choroba. (Hematoxylín-eozín) 2: Senilné platne pozorované v mozgovej kôre u pacienta s Alzheimerovou chorobou. (Impregnácia striebra) 3: Králik jazyk, kolagénové vlákna (modrá). Svalové vlákna (fialové prúžky). (Masson's Trichromic). 4: Pečené tkanivo s tukovou degeneráciou. (Sudán III) 5: Formed Pečeň. Nekróza. (Toluidine Blue) Zdroje: Wikipedia. com/USEER: KGH [CC BY-SA 3.0 (http: // creativeCommons.Org/licencie/By-SA/3.0/)]/Public Domain Files/Mohit Lalwani [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)]
1: Paget Extramamamaria Choroba. (Hematoxylín-eozín) 2: Senilné platne pozorované v mozgovej kôre u pacienta s Alzheimerovou chorobou. (Impregnácia striebra) 3: Králik jazyk, kolagénové vlákna (modrá). Svalové vlákna (fialové prúžky). (Masson's Trichromic). 4: Pečené tkanivo s tukovou degeneráciou. (Sudán III) 5: Formed Pečeň. Nekróza. (Toluidine Blue) Zdroje: Wikipedia. com/USEER: KGH [CC BY-SA 3.0 (http: // creativeCommons.Org/licencie/By-SA/3.0/)]/Public Domain Files/Mohit Lalwani [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)] Týmto spôsobom je možné určiť metabolickú úlohu, s ktorou sa tieto látky stretávajú v bunke.
Cytochémia používa dve hlavné metódy. Prvý je založený na chemických a fyzikálnych postupoch. Tieto techniky sa uchýlia k použitiu mikroskopu ako nevyhnutného nástroja na vizualizáciu chemických reakcií, ktoré sa vyskytli na špecifických látkach v bunke.
Príklad: Použitie cytochimimických farbív, ako je reakcia reakcie Ferexgen alebo PAS,.
Druhá metóda je založená na biochémii a mikrochémii. S touto metodikou je možné kvantitatívne určiť prítomnosť intracelulárnych chemikálií.
Medzi látkami, ktoré môžu byť preukázané v bunkovom tkanive alebo štruktúre, patria nasledujúce: proteíny, nukleové kyseliny, polysacharidy a lipidy.
[TOC]
História cytochémie
Cytochemické techniky od ich vynálezu pomohli porozumieť zloženiu buniek a časom sa objavili rôzne techniky, ktoré používajú rôzne typy farbív s príbuznosťou a rozdielnymi základmi.
Následne cytochémia otvorila nové horizonty s použitím určitých substrátov na zafarbenie prítomnosti enzýmov alebo iných molekúl vo vnútri bunky.
Podobne sa objavili aj ďalšie techniky, ako je imunocytociýcia, ktoré mali veľkú pomoc pri diagnostike mnohých chorôb. Imunocytochémia je založená na reakciách antigénov-protilátka.
Na druhej strane cytochémia tiež používala fluorescenčné látky nazývané fluórochrómy, ktoré sú vynikajúcimi markermi na detekciu určitých bunkových štruktúr. Kvôli charakteristikám fluórochrómu zdôrazňuje štruktúry, na ktoré boli nastavené.
Čo študuješ?
Rôzne cytochemické techniky používané na biologickej vzorke majú niečo spoločné: zvýraznenie prítomnosti špecifického typu látky a poznanie jej polohy v rámci hodnotenia biologickej štruktúry, či už ide o typ bunky alebo tkanivo.
Tieto látky môžu byť enzýmy, ťažké kovy, lipidy, glykogén a definované chemické skupiny (aldehydy, tyrozín atď.).
Informácie poskytnuté týmito technikami môžu viesť nielen na identifikáciu buniek, ale aj na diagnostiku rôznych patológií.
Napríklad cytochemické farbenie je veľmi užitočné na rozlíšenie medzi rôznymi typmi leukémie, pretože niektoré bunky exprimujú určité kľúčové enzýmy alebo látky a iné nie.
Na druhej strane by sa malo poznamenať, že na to, aby bolo možné použitie cytochémie, je potrebné sa vziať tieto úvahy:
Môže vám slúžiť: Gram Stain1) Látka musí byť imobilizovaná na mieste, kde je prirodzene.
2) Látka musí byť identifikovaná pomocou substrátov, ktoré s ňou reagujú špecificky, a nie s inými zlúčeninami.
Úžitkový
Vzorky, ktoré je možné študovať pomocou cytochemických techník, sú:
- Predĺžená periférna krv.
- Predĺžená kostná dreň.
- Látky nastavené na histochemické techniky.
- Cytocentrifugačné bunky.
Cytochemické techniky majú veľkú podporu v oblasti hematológie, pretože sa široko používajú na pomoc pri diagnostike a diferenciácii určitých typov leukémie.
Napríklad: Ratting Reacts slúži na rozlíšenie medzi myelomonocytovou leukémiou od akútnej monocytovej leukémie.
Rozkvaly kostnej drene a periférna krv týchto pacientov sú podobné, pretože niektoré bunky je ťažké identifikovať iba z morfologického hľadiska. Za týmto účelom sa vykonáva test nehnuteľností.
V prvom poskytovaní pozitívnych konkrétnych rohoží, zatiaľ čo v druhom je nešpecifické záležitosti pozitívne.
Sú tiež veľmi užitočné v histológii, pretože napríklad použitie techniky sfarbenia ťažkých kovov (argickácia), zafarbuje intenzívne hnedé retikulárne vlákna v myokardiálnom tkanive.
Techniky v cytochémii
Najpoužívanejšie techniky budú vysvetlené nižšie:
- Používanie farbív
Použité farbivá sú v cytochemických technikách veľmi rôznorodé, ktoré sa dajú klasifikovať podľa niekoľkých názorov:
Podľa radikálu, pre ktoré majú afinitu
Sú rozdelené do: kyseliny, základné alebo neutrálne. Sú najjednoduchšie a najpoužívanejšie v histórii, čo umožňuje rozlíšenie bazofilných zložiek acidofilov. Príklad: Hematoxylín-eozín sfarbenie.
V tomto prípade sú centrá buniek zafarbené modrou farbou (berú hematoxylín, ktorý je základným farbivom) a červené cytoplazmy (berú eozín, ktorý je kyselinou sfarbením).
Podľa farby, ktorú poskytujú
Môžu byť orthochromatické alebo metacromatické. Ortochromatické sú tie, ktoré zafarbujú štruktúry rovnakej farby, aké má farbivo. Napríklad prípad eosiny, ktorej farba je červená a farbivá červené.
Metacromatický namiesto toho zafarbuje štruktúry inej farby ako ich farba, ako je toluidín, ktorej farba je modrá a napriek tomu farbivá fialová.
Životne dôležité alebo supravitálne sfarbenie
Sú neškodné sfarbenie, to znamená, že bunky zafarbujú a zostávajú nažive. Tieto farbivá sa nazývajú životne dôležité (napr. Modrý z Trivánu do farbenia makrofágov) alebo supravitálny (napr. Janus's Green to Farb Mitochondria alebo neutrálnu červenú farbu, ktorá farbije lyzozómy).
- Detekcia lipidov prostredníctvom tukov rozpustných farbív
Osmium tetroxid
Farbenie lipidov (nonsýtené mastné kyseliny) čierne. Túto reakciu je možné pozorovať pomocou optického mikroskopu, ale preto, že toto farbivo má vysokú hustotu, je možné zobraziť aj elektronický mikroskop.
Sudán III
Je jedným z najpoužívanejších. Toto farbivo sa šíri a rozpustí v tkanivách a hromadí sa vo vnútri kvapiek lipidu. Farba je šarlátová červená.
Farbenie čierneho Sudánu B
Vytvára lepší kontrast ako predchádzajúce, pretože je tiež schopný rozpustiť sa vo fosfolipidoch a cholesterolu. Je užitočný na detekciu azurofilných a špecifických granúl zrelých granulocytov a ich prekurzorov. Preto identifikuje myeloidné leukémiu.
Môže vám slúžiť: metyltá červená: Charakteristiky, príprava a aplikácie- Tinion of Aldehydes (Schiffove farbenie kyseliny perchyovej)
Farbenie kyseliny periódovej z Periódovej dokáže zistiť tri typy skupín dedín. Oni sú:
- Voľné aldehydy, prirodzene prítomné v tkanivách (plazmálna reakcia).
- Aldehydy produkované selektívnou oxidáciou (reakcia PAS).
- Aldehydos generovaný selektívnou hydrolýzou (faulgenská reakcia).
Reakcia PAS
Toto zafarbenie je založené na detekcii určitých typov uhľohydrátov, ako je glykogén. Schiffova kyselina periódová prelomí väzby c-c uhľohydrátov v dôsledku oxidácie 1-2 glykolických skupín a uvoľňuje aldehydové skupiny.
Skupiny voľných aldehydov reagujú s činidlom Schiff a tvoria fialovú červenú zlúčeninu. Vzhľad fialovej červenej farby ukazuje pozitívnu reakciu.
Tento test poskytuje pozitívne v rastlinných bunkách, detekuje škrob, celulózu, hemicelulózu a peptíny. Zatiaľ čo v živočíšnych bunkách detekuje mukíny, mukoproteíny, kyselinu hyalurónovú a chitín.
Okrem toho je užitočný pri diagnostike lymfoblastických leukémií alebo erytrleukémie, okrem iných patológií myelodisplastického typu.
V prípade kyslých uhľohydrátov je možné použiť zväzok modrej Alciánu. Test je pozitívny, ak sa pozoruje svetlo modrá/tyrkysová farba.
Plazmálna reakcia
Plazmálna reakcia zdôrazňuje prítomnosť určitých dlhých alifatických aldehydov, ako je palmital a stearal. Táto technika sa vzťahuje na mrazené histologické rezy. Je to priamo s Schiffovým činidlom.
Reakcia
Táto technika detekuje prítomnosť DNA. Táto technika pozostáva z podrobenia tkaniva fixovaného na slabú hydrolýzu kyseliny, aby neskôr reagovala so Schiffovým činidlom.
Listy hydrolýzy odhalili aldehydy deoxyribózy na úrovni deoxyribóz-purín. Potom Schiffovo činidlo reaguje s aldehydmi, ktoré boli zadarmo.
Táto reakcia je pozitívna v jadrách a negatívna v cytoplazmoch buniek. Pozitivita je dokazovaná prítomnosťou červenej farby.
Ak je táto technika kombinovaná so zeleným pyronínom, je možné súčasne detegovať DNA a RNA.
- Cytochimimické farbenie pre proteínové štruktúry
Na tento účel je možné použiť Millonovu reakciu, ktorú sa dusičnan ortuť používa ako činidlo. Štruktúry obsahujúce aromatické aminokyseliny budú farbené červené.
- Cytochemické farbenie, ktoré používa substráty na demonštráciu prítomnosti enzýmov
Tieto farbenia sú založené na inkubácii biologickej vzorky s daným substrátom a reakčný produkt neskôr reaguje s diazoickými soľami za vzniku farebného komplexu.
Esterasas
Tieto enzýmy sú prítomné v lyzozómoch niektorých krviniek a sú schopné hydrolyzovať organické estery uvoľňujúce naftol. Tento posledný tvorí nerozpustný cukor, keď sa spojí s dialyage soľou a zafarbuje miesto, kde sa vyskytuje reakcia.
Existuje niekoľko substrátov a v závislosti od toho, ktorý je možné použiť. Prvý je prítomný v nezrelých bunkách série myeloidov a druhý v bunkách monocytického pôvodu.
Môže vám slúžiť: Základná tkanina: Čo je, charakteristiky a funkcieSubstrát použitý na stanovenie špecifických rohoží je: naftol-as-D chlóracetát. Zatiaľ čo na stanovenie nešpecifických rohoží, niekoľko substrátov, ako je acetát naftol, nafylský acetát konfet a butyrát nafyl alfa.
V obidvoch prípadoch budú bunky zafarbené červenou červenou farbou, keď je reakcia pozitívna.
Myeloperoxidáza
Tento enzým sa nachádza v azurofilných granulách granulocytárnych a monocytových buniek.
Jeho detekcia sa používa na rozlíšenie leukémie myeloidného pôvodu vzhľadom na lymfoidy. Bunky obsahujúce myeloperoxidázy Colo z oker žltej.
Fosfatázy
Tieto enzýmy uvoľňujú kyseliny fosforečnej z rôznych substrátov. Líšia sa od seba podľa špecifickosti substrátu, pH a pôsobenia inhibítorov a inaktivátorov.
Medzi najznámejšie patria fosfomonosterae, ktoré hydrolyzujú jednoduché estery (P-O). Príklad: Alkalická fosfatáza a kyslá fosfatáza, ako aj fosfamidázy, ktoré hydrolyzujú odbory (p-n). Používajú sa na diferenciáciu lymfoproliferatívnych syndrómov a na diagnostiku tricholeukémie.
- Trikromické sfarbenie
Trichromický klenot
Sú užitočné na rozlíšenie cytoplazmy od buniek bunkových vlákien. Bunky sú farbené červené a modré kolagénové vlákna.
Masson's Trichromic
To má rovnakú užitočnosť ako predchádzajúce, ale v tomto prípade sú bunky zafarbené červené a kolagénové vlákna zelených.
- Farbivo, ktoré farbia špecifické organely
Janus Green
To selektívne zafarbí mitochondrie.
Soli kyseliny striebro a osmiálna
Zafarbenie do golgiho aparátu.
Toluidínová modrá
Nissiho telá škvrny
Sotáre striebro a pas
Retikulárne vlákna a škvrna o bazálnom plechu.
Resorcín orceín a fuchsin
Zafarbiť elastické vlákna. S prvými sú zafarbení hnedou farbou a s druhou modrou alebo intenzívnou fialovou.
- Iné techniky používané v cytochémii
Použitie fluorescenčných alebo fluórochrómov
Existujú techniky, ktoré používajú fluorescenčné látky na štúdium umiestnenia štruktúry v bunke. Tieto reakcie sa vizualizujú špeciálnym mikroskopom nazývaným fluorescencia. Príklad: IFI Technika (nepriama imunofluorescencia).
Detekcia bunkových zložiek imunocytochémiou
Tieto techniky sú veľmi užitočné v medicíne, pretože pomáhajú detekovať určitú bunkovú štruktúru a tiež ju kvantifikujú. Táto reakcia je založená na reakcii antigénu-protilátka. Napríklad: Elisa techniky (enzýmová imuno esej).
odporúčania
- Na vyhodnotenie správneho fungovania farbív je potrebné použiť ovládacie prvky náteru.
- Čerstvá náter by sa mala použiť na vystavenie cytochemickým farbám. Ak to nie je možné, musia byť chránené pred svetlom a zachované pri 4 ° C.
- Malo by sa postarať o to, že použitý fixér nemá negatívny vplyv na látku na vyšetrenie. To znamená, že by sa malo vyhnúť, aby to bolo schopné ich extrahovať alebo inhibovať.
- Čas používania fixátorov musí byť rešpektovaný, pretože by mal zvyčajne trvať iba sekundy, pretože vystavenie náter viac času fixácii môže poškodiť niektoré enzýmy.
Odkazy
- „Cytochymikia.„ Wikipedia, encyklopédia zadarmo. 30. júna 2018, 17:34 UTC. 9. júla 2019, 02:53 K dispozícii na: Wikipedia.orgán
- Villarroel P, z Suárez C. Metódy impregnácie kovu na štúdium vlákien siete myokardu: porovnávacia štúdia. RFM 2002; 25 (2): 224-230. K dispozícii na: SCIELO.orgán
- Santana A, Lemes A, Bolaños B, Parra A, Martín M, Molele T. Cytochémia kyslej fosfatázy: metodologické úvahy. Rev Diagn Biol. 200; 50 (2): 89-92. K dispozícii na: SCIELO.orgán
- Autor: Robertis E, Robertis M. (1986). Bunková a molekulárna biológia. 11 Goes Edition. Ateneo redaktor. Buenos Aires, Argentína.
- Klasické nástroje na štúdium v bunkovej biológii. TP 1 (doplnkový materiál) - Bunková biológia. K dispozícii na: DBBE.fcen.Uba.ar
- « Maristická revolúcia príčiny, etapy, dôsledky a postavy
- Geologický pôvod, charakteristika Tichého oceánu, vlastnosti, počasie, flóra a fauna »

