Kinetický enzým
- 4472
- 1147
- Denis Škriniar
Čo je enzymatická kinetika?
Ten Kinetický enzým Je to študijné pole, v ktorom sa stretávajú fyzikálna pôsobnosť a biochémia, aby študovali chemické reakcie katalyzované enzýmami. Enzýmy sú biologické katalyzátory, ktoré zvyšujú rýchlosť chemickej reakcie znížením ich aktivačnej energie.
Enzýmy katalyzujú chemické reakcie s veľkým významom pre udržiavanie života. Majú pH aj optimálnu teplotu na vykonávanie katalytického pôsobenia na substrát, takže sú to základné faktory v štúdiu svojich činností.
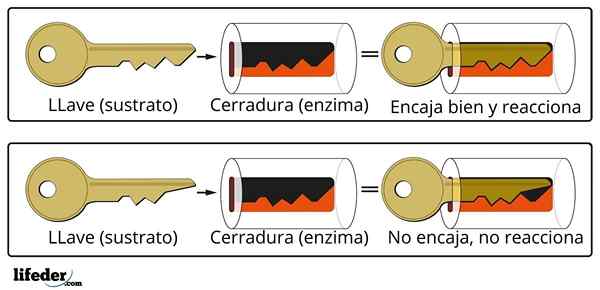
 Systém na zakrývanie kľúčov je približná analógia s systémom substrátu-enzým.
Systém na zakrývanie kľúčov je približná analógia s systémom substrátu-enzým. Enzým interaguje so substrátom prostredníctvom špecializovanej oblasti jeho proteínového reťazca, ktorý sa nazýva aktívne centrum, ktorého trojrozmerná štruktúra je spojená s štruktúrou substrátu. Interakcia medzi aktívnym centrom a substrátom je zvyčajne slabá a nie kovalentná.
Počet aktívnych enzýmových centier je obmedzený a vytvára svoju saturáciu molekulami substrátu, čo zase bráni zvýšeniu rýchlosti reakcie nad určitú hodnotu, známu ako maximálna rýchlosť.
Enzymatická kinetika nielen kombinuje biochémiu a fyzikálnu konanie, ale aj bioinorganickú, supramolekulárnu chémiu, výpočtovú chémiu a štatistiku.
Medzi modely, ktoré to popisujú, patrí model Michaelis -. Dnes je to stále jeden z modelov, ktorý sa najviac používa na opis enzymatickej kinetiky.
Základné koncepty v enzymatickej kinetike
Enzymatická katalýza
Enzýmy sú proteíny s katalytickými aktivitami, ktoré sú schopné pôsobiť na molekulu nazývanú substrát, čím katalyzujú jeho transformáciu do inej látky známej ako produkt. Enzýmy sa počas katalytického pôsobenia nespotrebujú, zostávajú ich konštantnou hmotnosťou.
Katalytická aktivita
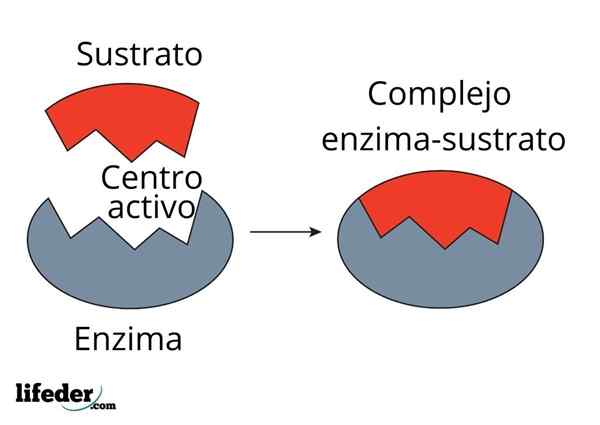
Katalytická aktivita enzýmu sa vykonáva v špecializovanej trojrozmernej štruktúre známej ako aktívne centrum. Toto je tvorené záhybom enzymatického proteínového reťazca, ktorý určuje interakciu skupiny aminokyselín, ktoré tvoria aktívne centrum.
Aktívne centrum
Aktívne centrum nie je tuhá štruktúra, ale je schopná geometrického prispôsobenia sa substrátu na interakciu s ním. Interakcia je všeobecne slabá (sily van der Waals), hoci existujú enzýmy, ktoré tvoria kovalentné spojenie so substrátom.
Môže vám slúžiť: Butyrický tuk: získanie, typy, zloženie, použitia, výhodyZnížená aktivačná energia
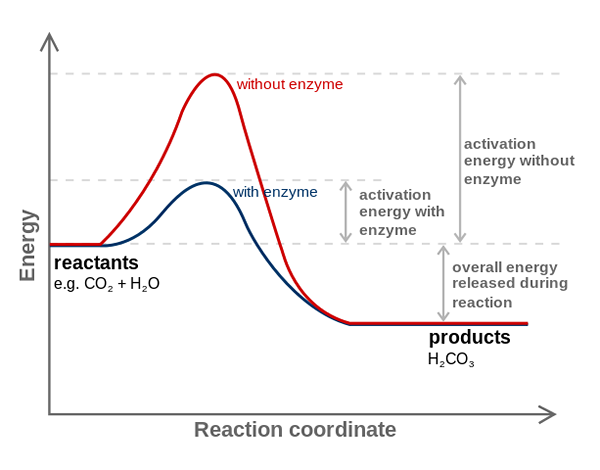 Enzým z karbonovej anhydrázy znižuje aktivačnú energiu pre konverziu CO2 na H2CO3. Zdroj: Fvasconcellos (Talk • Contribs), CC BY-SA 3.0, cez Wikimedia Commons
Enzým z karbonovej anhydrázy znižuje aktivačnú energiu pre konverziu CO2 na H2CO3. Zdroj: Fvasconcellos (Talk • Contribs), CC BY-SA 3.0, cez Wikimedia Commons Enzýmy katalyzujú reakcie znižujúce aktivačnú energiu, a preto tiež znižujú spotrebu voľnej energie (g) potrebnej na dokončenie katalyzovaného procesu. Enzýmy modifikujú rovnovážny bod nekatalyzovaných chemických reakcií.
Všimnite si, ako enzým karbony anhydrázy znižuje aktivačnú energiu pre spoločnú konverziu2 do h2Co3. Aj keď sa vzdialenosť medzi červenou a modro -modrou čiarou nevyzerá príliš, tento enzým zvyšuje rýchlosť v poradí miliónov krát (106), v porovnaní s reakciou vykonanou bez ich účasti.
Stereopecifickosť
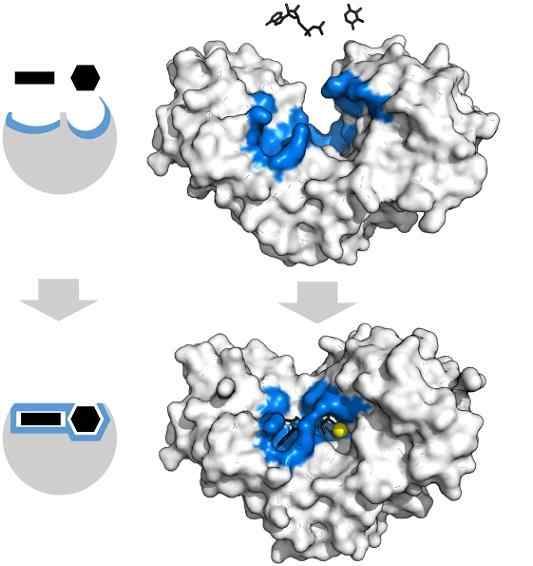 Adenozínové substráty Tryfosfát a xylóza majú špecifickú formu, ktorá sa zhoduje s geometriou aktívneho centra enzýmu hexoquinázy. Zdroj: Thomas Shafee, CC po 4.0, cez Wikimedia Commons
Adenozínové substráty Tryfosfát a xylóza majú špecifickú formu, ktorá sa zhoduje s geometriou aktívneho centra enzýmu hexoquinázy. Zdroj: Thomas Shafee, CC po 4.0, cez Wikimedia Commons Enzýmy sú vo všeobecnosti vysoko špecifické pre reakcie, ktoré katalyzujú, pretože molekuly substrátu musia interagovať s aktívnym centrom, ktoré predstavuje súbor požiadaviek na ich spojenie s ním.
Napríklad aktívne centrum hexoquinázy, ktoré je dynamické v dôsledku molekulárnych vibrácií proteínových reťazcov, ponúka skupiny v presných priestorových orientáciách, takže molekuly adenozínu a xylózy adenozínu, vápno, akoby to boli kusy, ktoré plnia geometrické geometrické.
Najmenšie fyzikálne alebo chemické narušenie a oblasť modrej -hexoquinázy už nemôžu ubytovať substráty.
Maximálna rýchlosť
Enzýmy majú obmedzený počet aktívnych centier, takže zvýšením koncentrácie substrátu. To určuje, že rýchlosť katalyzovanej reakcie sa nemôže zvýšiť nad určitú hodnotu, známa ako maximálna rýchlosť.
Citlivosť na teplotu a pH
Enzymatická katalytická aktivita závisí od teploty a pH, ktorá má optimálne hodnoty týchto parametrov pre svoju prevádzku. Podobne, pretože ide o molekuly proteínov enzýmov, sú náchylné na chemickú alebo tepelnú denaturáciu.
Kofaktory
Niektoré enzýmy zvyšujú svoju katalytickú aktivitu v dôsledku vplyvu určitých faktorov, ktoré môžu byť kovy alebo organické zlúčeniny známe ako koenzýmy.
Podobne môžu byť enzýmy inhibované konkurenčne a konkurenčne. V prípade hexoquinázy zhora, mg2+ (žltá guľa) pôsobí ako kofaktor.
Enzymatická reakčná rýchlosť
Rýchlosť enzymatickej reakcie závisí od koncentrácie substrátu a enzymatickej koncentrácie. Ak je koncentrácia substrátu nízka, existuje takmer lineárny vzťah medzi enzymatickou rýchlosťou a koncentráciou substrátu.
Môže vám slúžiť: Žiadne kovy: História, vlastnosti, skupiny, použitiePreto sa enzymatická rýchlosť zvyšuje priamy úmerný koncentrácie substrátu; Ale zvýšením koncentrácie substrátu na hodnotu, ktorá nasýti aktívne miesta enzýmu, sa dosiahne maximálna rýchlosť.
Akonáhle dôjde k enzymatickej rýchlosti, stáva sa konštantnou, to znamená, že je nezávislá od koncentrácie substrátu a hovorí sa, že enzymatická rýchlosť je nula. Okrem toho je katalytická enzymatická rýchlosť úmerná koncentrácii komplexu enzým-substrát [IS].
Ako ukazuje matematický výraz:
V = k2[JE]
Maximálna rýchlosť je priamo úmerná celkovej koncentrácii enzýmu, ako sa zdá v nasledujúcom vzorci:
VložkaMaximálny = KMačkaAtón
KlimatizovaťMačka Je to číslo rotácie alebo náhrady a predstavuje počet molekúl substrátu, ktoré každé enzymatické miesto premieňa na produkt na jednotku času. Zatiaľ čotón predstavuje počet katalytických enzymatických miest. Ánotón Má vysokú hodnotu, na nasýtenie aktívnych miest alebo centier je potrebný vyšší [S].
Michaelis -mente rovnica
Model
Model Mihaelis -mente je založený na pôsobení enzýmov, ktoré pôsobia na jednoduchý substrát a nie sú použiteľné na výlučné enzýmy; to znamená, že tie, ktoré majú regulačnú oblasť katalytickej aktivity aktívneho miesta.
Enzýmy pri nízkej koncentrácii substrátu majú katalytickú aktivitu, ktorá je lineárna s koncentráciou substrátu; Ale pri vysokých koncentráciách substrátu je katalytická aktivita nezávislá od koncentrácie substrátu.
V roku 1913 Leonor Michelis a Maud Moped navrhli model na vysvetlenie naznačeného enzymatického správania, existencie enzým-astrato sprostredkovateľského komplexu je dôležitý v modeli [IS].
Všeobecná rovnica
Vzťah tohto komplexu s ostatnými zložkami enzymatického procesu, ako aj s konštántami (k), ktoré ich súvisia, je uvedený v nasledujúcej schéme:
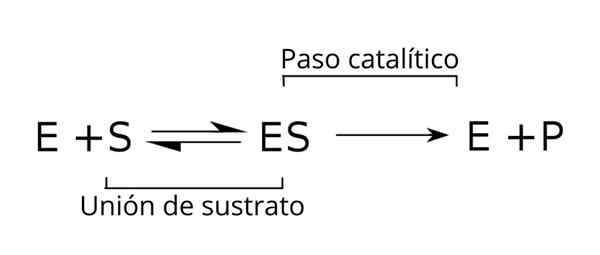 Všeobecná rovnica substrátov, enzým-substrátový komplex a produkty enzymatickej kinetiky. Zdroj: Tim Vickers Via Wikipedia.
Všeobecná rovnica substrátov, enzým-substrátový komplex a produkty enzymatickej kinetiky. Zdroj: Tim Vickers Via Wikipedia. Enzým (E) je kombinovaný so substrátom (s) za vzniku komplexu enzým-substrát s konštantou rýchlosti K-rýchlosti1. Komplex E-S sa môže disociovať v E a S s konštantou reakčnej rýchlosti k-1.
Podobne je komplex spôsobený produktom (P) a separáciou enzýmu, ktorý je možné recyklovať, aby sa splnil ďalší cyklus enzymatickej aktivity. Pre štát je možné dosiahnuť rovnovážnu situáciu, v ktorej sa jeho rýchlosť formovania rovná rýchlosti rozkladu.
Môže vám slúžiť: prírodné chemické prvkyKlimatizovať1[Je] [s] = (k-1 + Klimatizovať2) [Je] (1)
Preskupenie podmienok a zúčtovania [IS], máte:
[Je] = ([e] [s]) / (k-1 + Klimatizovať2 / K1) (2)
KlimatizovaťM = (K-1 + Klimatizovať2) / K1
KlimatizovaťM Je to konštanta, ktorú predstavil Michaelis.
Podmienky Michaelis -mente rovnice
Výmena teraz kM V (2) pokračujeme:
[Je] = [e] [s] / kM (3)
Koncentrácia nekombinovaného enzýmu je:
[E] = [eTón] - [es] (4)
Kde [e] je voľný enzým a [eTón] Celková koncentrácia enzýmu.
Kombinácia rovníc 3 a 4, vďaka čomu sú substitúcie splatné a berúc do úvahy vMaximálny, Michaelis-Muene Rovnica sa dosiahne, vyjadrená nasledujúcim spôsobom:
V = (vMaximálny [S]) / ([s] + kM)
Maximálna rýchlosť enzymatickej reakcie dochádza, keď je koncentrácia substrátu oveľa väčšia ako kM A katalytické miesta enzýmov sú nasýtené substrátom. K tomu dochádza, keď vzťah [s]/[s] + kM Prístupy k 1.
Keď sa [s] rovná KM, Časť rovnice [s] / [s] + kM sa rovná 1/2, čo naznačuje, že kM Je to koncentrácia substrátu, ktorá vytvára enzymatickú reakčnú rýchlosť, ktorá je polovičnou maximálnou rýchlosťou.
Okrem toho KM Je to miera afinity enzýmu substrátom: čím väčšia je hodnota kM, Minor bude afinita enzýmu pre substrát a naopak. Preto k KM Vysoká rýchlosť enzymatickej reakcie bude nízka.
Graf
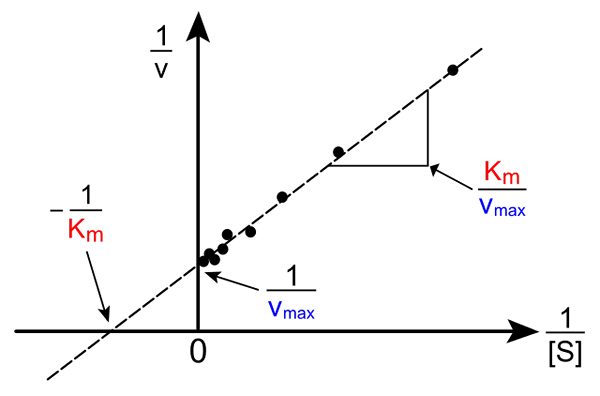 Šupka. Zdroj: Pro Catcher Bug Catcher cez Wikipedia.
Šupka. Zdroj: Pro Catcher Bug Catcher cez Wikipedia. Transformácia rovnice Michaelis-Muene na vytvorenie jej inverznej formy má nasledujúcu formu:
1/v = (kM / VMaximálny) (1 / [s]) + 1 / vMaximálny
Dôležitosť tejto línie je v tom, že má križovatku s osou x v - 1/kM, a s osou y pri y = 1/vMaximálny (horný obrázok). Čiara má sklon kM/Vmax. To umožňuje informácie o VMaximálny a kM grafy inverznej rýchlosti v závislosti od inverzie koncentrácií substrátu.
Odkazy
- Strayer, L. (1975). Biochémia. 2dávať Vydanie. Redaktor sa vrátil.
- Irán. Levine. (2009). Princípy fyzikálneho spôsobu. Šieste vydanie. MC Graw Hill.
- Wikipedia. (2020). Kinetika enzýmov. Zdroj: In.Wikipedia.orgán
- Michael Blaber. (5. júna 2019). Kinetika enzýmov. Biologické librettexts. Získané z: Bio.Librettexts.orgán
- Redaktori Enyclopaedia Britannica. (2020). Kinetika Michaelis-Muen. Získané z: Britannica.com
- Berg JM, Tymoczko JL, Stryer L. Biochémia. 5. vydanie. New York: W H Freeman; (2002). Oddiel 8.4: Michaelis-model predstavuje kinetické vlastnosti mnohých enzýmov. Získané z: NCBI.NLM.NIH.Vláda

