Kyseliny a bázy rozdiely, charakteristiky, príklady
- 4321
- 956
- JUDr. Rudolf Čapkovič
Ten kyseliny a základy Sú to chemické zlúčeniny, ktoré nepredstavujú jednu definíciu, ale niekoľko, ktoré závisia od charakteristík alebo vlastností, ktoré sa berú do úvahy. Vo všeobecnosti by sa dalo povedať, že kyseliny sú kyslé látky, zatiaľ čo základne sú saponáceas alebo mydlá.
Najdôležitejšie definície, ako napríklad Brönsted-Lowry alebo Arrhenius, sa viac zameriavajú na uvoľnenie H iónov3Ani+ (Hydronium) u OH-(hydroxyl) týmito látkami. Buď vo svojich čistých alebo rozpustených formách vo vode.
Definícia, ktorá vzniká v dôsledku vyššie uvedeného, je nasledujúca: kyseliny rozpustené vo vode generujú roztoky s hodnotami pH menšími ako 7, zatiaľ čo rozpustené bázy produkujú roztoky s hodnotami pH vyšším ako 7. PH je presne spôsob, ako vyjadriť, ako kyslý alebo základný je kvapalina, ktorá sa berie do úvahy koncentrácia H3Ani+.
Preto kyslé látky, ako je pomarančová šťava, majú pH menej ako 7 a veľa H iónov3Ani+. Zatiaľ čo základne, ako napríklad Legía, majú pH viac ako 7 a veľa OH iónov-.
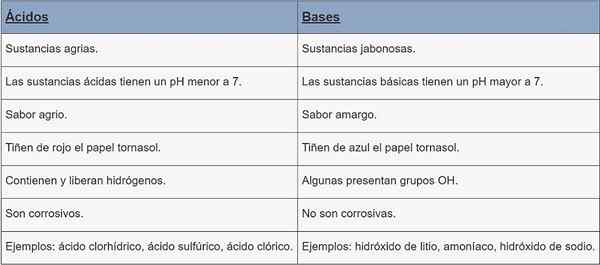
Kyseliny | Základne | |
Typ látky | Agrárne látky. | Látky Jabonesas. |
pH | pH menej ako 7. | pH väčšie ako 7. |
Príchuť | Kývku. | Horký. |
Zafarbenie | Papier. | Cornstasol Paper Farbenie modrej farby. |
Charakteristika | Obsahujú a uvoľňujú hydrogény. | Niektoré prítomné OH skupiny. |
Korózia | Sú korozívne. | Nie sú korozívne. |
Príklady | Kyselina chlorovodíková, kyselina sírová, kyselina chlorovodíková. | Hydroxid lítium, amoniak, hydroxid sodný. |
Kyseliny
 Pomarančová šťava je jedným z najznámejších zástupcov kyseliny nášho každodenného života
Pomarančová šťava je jedným z najznámejších zástupcov kyseliny nášho každodenného života Kyslé charakteristiky
Kyslé látky majú určité vlastnosti:
Kyslá chuť
Kyseliny majú kyslú chuť. Bežne je typ chuti označený pojmom „kyselina“. Hovorí sa teda, že citrónová šťava a kvapalina nejakej ďasien sú kyseliny, pretože jej príchute sú kyslé a silné pre podnebie.
Papier
Kyseliny sú látky schopné otočiť farbu modrej na červený sprejový papier. Shortrasol je súčasťou súboru látok, ktoré môžu zmeniť farbu v závislosti od stupňa kyslosti alebo základnosti prostredia, v ktorom sa nachádzajú. Tieto látky sa nazývajú ukazovatele pH.
Môže vám slúžiť: koligatívne vlastnosti riešeníObsahujú a uvoľňujú hydrogény
Kyseliny sú chemické zlúčeniny, ktoré majú chemický prvok vodíka (H), čo mu dáva svoju kyslosť charakteristiky.
Mnoho ďalších látok obsahuje aj vodík, ale nemôžu ho uvoľniť tak, ako sa to stáva pri kyselinách. Pri oslobodzovaní je vodík vo forme iónu alebo katiónu+. Tieto h+, Pri stretnutí s molekulami vody sa k nim pridávajú, aby vytvorili H ióny3Ani+.
Prepravujú elektrický prúd
Kvôli atómom H+ ktoré sa uvoľňujú, keď sa kyseliny vo vode rozpustia, sú schopné prepravovať elektrinu pomocou batérií alebo batérií.
Sú korozívne
Existujú silné kyseliny, ktoré sú veľmi korozívne. Preto by sa malo vyhnúť kontaktu s nimi, pretože môžu spôsobiť vážne fyzické poškodenie. Dokonca aj slabé kyseliny, pri veľmi vysokých koncentráciách, ako je octic (ocot), môže kožu a hltanu spáliť, ak sú ich výpary vdýchnuté.
Silné a slabé
Silné kyseliny produkujú veľkú koncentráciu H iónov3Ani+ Keď sa rozpustia vo vode. Hovorí sa, že atómy vodíka silných kyselín sa ľahko disociujú. Medzitým slabé kyseliny uvoľňujú niekoľko atómov vodíka, a preto produkujú nižšiu koncentráciu H iónov3Ani+.
Silné kyseliny majú veľmi nízke pH, ktoré v závislosti od koncentrácie a sily kyseliny môžu byť 1 alebo menej. Namiesto toho majú slabé kyseliny vyššie kyslé pH, ktoré môže byť napríklad 4 alebo 5.
Silné kyseliny majú vôňu, ktorá vytvára spaľovací pocit. Medzitým slabé kyseliny tento typ zápachu nepredstavujú, dokonca ani v niektorých prípadoch majú príjemné zápach. Existuje však veľa výnimiek, takže sa neodporúča cítiť ani slabé kyseliny.
Môže vám slúžiť: oxid železa (iii): Štruktúra, nomenklatúra, vlastnosti, použitiaSilné kyseliny sú dobrými prepravcami elektriny. Naopak, slabé kyseliny sú zlými vodičmi elektriny uvoľňovaním niekoľkých atómov H+.
Silné kyseliny sú schopné napadnúť kovy, ako je zinok, tvoriace veľké množstvo vodíkových bublín. Táto reakcia nie je produkovaná slabými kyselinami.
Príklady kyselín
Silné kyseliny
-HCL: kyselina chlorovodíková
-H2SW4: kyselina sírová
-HBR: Kyselina bromhydrová
-Ahoj: Kyselina yodhydrová
-Hned3: kyselina dusičná
-HCLO4: Kyselina chlorová
-HCLO3: Kyselina chlorovodíková
Slabé kyseliny
-Chvály3COOH: kyselina octová
-Hned2: Kyselina dusná
-H2Co3: Kyselina uhličitá
-H3Po4: kyselina fosforečná
-C3H5O (COOH): Kyselina citrónová
-HF: Kyselina fluorhydrová
-H2SW3: Kyselina sírna
Základne
 Amoniak je základná látka
Amoniak je základná látka Základné charakteristiky
Základy predstavujú nasledujúce charakteristiky:
-Vytvárajú viskózny alebo mydlový pocit v prstoch, čo spôsobuje, že objekty sa ruky stanú klzkým.
-Majú horkú chuť.
-Môžu reagovať s kyselinami a vytvárajú tvorbu zlúčenín nazývaných soli. V niektorých prípadoch môžu zrážať alebo ponoriť do vody. V reakcii bázy s kyselinou sa vytvorí voda.
-Otáčajú farbu papiera s modrým klíčkom, čo naznačuje, že roztok má pH väčšie ako 7 alebo alkalické.
-Niektoré základne prítomné v ich chemických receptúre OH skupiny, nazývané hydroxilli, ktoré sú tvorené atómom vodíka a atómom kyslíka.
Silné a slabé
Silné bázy sú chemické zlúčeniny, ktoré predstavujú jednu alebo viac skupín OH v ich chemickej štruktúre, ktoré keď prídu do styku s vodou, získate negatívne zaťaženie, OH-.
Medzitým sa slabé základy nevyskytujú v ich chemických skupinách hydroxilov. Slabé základne pri reagovaní s vodou tiež produkujú ióny alebo anióny OH-.
Silné základne, ako je hydroxid sodný, majú veľmi vysoké hodnoty pH, takmer 14. Medzitým majú slabé základne nižšie pH, napríklad amoniak, ktorý má pH 11.
Môže vám slúžiť: varenie: Koncept, typy a príkladySilné základne sa používajú v domácnostiach na odhalenie odtokov. Taký je prípad hydroxidu draselného. Medzitým sa slabé základne používajú pri čistiacich prácoch, ako je amoniak prítomný v mnohých čistiacich prostriedkoch.
Príklady základní
Silné základne
-LIOH: hydroxid lítium
-NaOH: hydroxid sodný
-KOH: hydroxid draselný
-RBOH: Rubidio Hydroxid
-CSOH: Hydroxid cesium
-SR (OH)2: Stronciový hydroxid
-Ba (oh)2: hydroxid bária
Slabé základne
-NH3: Amoniak
-NHET2: dietylamín
-NH2Chvály3: Metilamín
-C5H5N: pyridín
Rozdiely medzi kyselinami a základňami
Ióny, ktoré uvoľňujú
Kyseliny uvoľňujú atómy H+ alebo h3Ani+ Keď sa rozpustia vo vode. Medzitým sa základy uvoľňujú alebo produkujú v kontakte s vodnými iónmi OH-.
Hodnoty pH
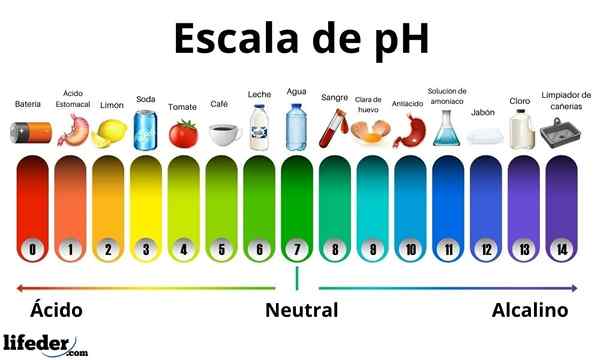
Kyseliny majú hodnotu pH medzi 0 a 7. Medzitým majú základy hodnotu pH medzi 7 a 14. Kyseliny preto otáčajú farbu klíčového papiera a základne ju otočia modrou farbou.
Tréningové reakcie
Kyseliny pochádzajú z reakcie oxidov nemetalických prvkov, napríklad chlóru, síry atď., S vodou alebo sa tiež tvoria, keď sa vodík kombinuje s nemetalickým prvkom a potom sa vytvorená zlúčenina rozpustí vo vode (HF, HCI, HBR atď.).
Základy sú produkované oxidovou reakciou kovu, napríklad železo, meď, horčík atď., S vodou. Malo by sa pamätať na to, že oxid je kombinácia atómov kyslíka s akýmkoľvek iným chemickým prvkom.
Odkazy
- Whitten, Davis, Peck & Stanley. (2008). Chémia. (8. vydanie.). Učenie sa.
- HelMestine, Anne Marie, PH.D. (11. februára 2020). Definícia kyseliny a príklad. Zotavené z: Thoughtco.com
- Vedecký prieskumník. (31. júla 2018). Výučba detí o kyselinách a základoch. Získané z: Science Areplirers.com
- Vypracovanie príkladu. (2013). Kyslé charakteristiky. Získané z: Exemplary.com
- Lúmenová chémia pre nevýborov. (s.F.). Vlastnosti kyselín a základní. Uzdravené z: kurzov.Lumenarning.com
- Clark Jim. (2013). Silné a slabé základne. Získané z: Chemguide.co.Uk
- « Flóra a fauna reprezentatívneho druhu ekvádorského Sierra
- Metodologický rámec, ako ho napísať, štruktúra, príklady »

