Štruktúra, vlastnosti a použitie kyseliny yodhydrovej (HI)
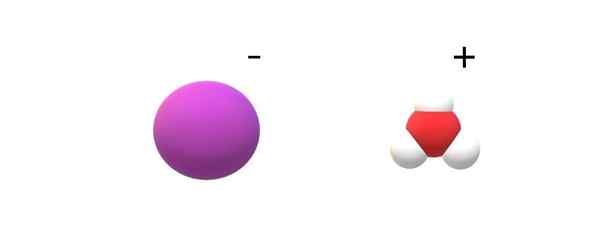
- 3165
- 972
- Gabriel Bahna
On kyselina iahydrová Je to vodný roztok vodíkového jodidu, ktorý sa vyznačuje jeho vysokou kyslosťou. Definícia viac pripojená k chemickej terminológii a IUPAC je, že je to hydracia, ktorej chemický vzorec je HI.
Avšak, aby sa rozlíšilo od plynných molekúl vodíka jodidu, HI (G), označuje sa ako HI (AC). Z tohto dôvodu je v chemických rovniciach dôležité identifikovať prostredie alebo fyzickú fázu, v ktorej boli činidlá a výrobky. Napriek tomu sú zvyčajne bežné zmätky medzi jodínom vodíka a kyselinou iarchovou.
 Ióny kyseliny iahydrovej. Zdroj: Gabriel Bolívar.
Ióny kyseliny iahydrovej. Zdroj: Gabriel Bolívar. Ak sa v ich totožnosti pozorujú odhodlané molekuly, nájdia sa notoricky známe rozdiely medzi HI (G) a HI (AC). V HI (G) je odkaz H-I; Zatiaľ čo v hi (ac) sú vlastne pár iónov i- a h3Ani+ Interakcia elektrostaticky (vynikajúci obraz).
Na druhej strane, HI (AC) je zdrojom HI (G), pretože prvý je pripravený rozpustením druhého vo vode. Z tohto. HI je silným redukčným činidlom a vynikajúcim zdrojom iónov i- Vo vodnom médiu.
[TOC]
Štruktúra kyseliny yodhydrovej
Kyselina yodhydrová, ako je vysvetlené, pozostáva z roztoku HI vo vode. Keď sú vo vode, HI molekuly sa úplne disociujú (silný elektrolyt), pôvod, ktorý pochádza z iónov i- a h3Ani+. Táto disociácia môže byť reprezentovaná s nasledujúcou chemickou rovnicou:
Ahoj (g) + h2Alebo (l) => i-(Ac) + h3Ani+(Ac)
Čo by bolo rovnocenné, ak by bolo napísané ako:
Ahoj (g) + h2Alebo (l) => hi (ac)
HI (AC) však vôbec neodhaľuje to, čo sa stalo s plynnými molekulami HI; Znamená to iba to, že sú vo vodnom médiu.
Preto skutočná štruktúra HI (AC) pozostáva z iónov i- a h3Ani+ obklopené molekulami vody ich zvlhčujú; Čím viac koncentrovanej kyseliny iahydrovej, tým nižší počet molekúl vody bez protónu.
Môže ti slúžiť: Boyle LawKomerčne je koncentrácia HI 48 až 57% vo vode; Koncentrovanejšie by bolo ekvivalentné tomu, že by bolo príliš fajčenie kyseliny (a ešte nebezpečnejšie).
Na obrázku je možné vidieť, že anión i- Je zastúpený fialovou guľou a h3Ani+ S bielymi guľami a červenou farbou pre atóm kyslíka. Katión H3Ani+ Predstavuje molekulárnu geometriu trigonálnu pyramídu (pozorovanú z vyššej roviny na obrázku).
Vlastnosti
Fyzický popis
Bezfarebná tekutina; Ak ste však v priamom kontakte s kyslíkom, môžete vykazovať žltkasté a hnedé tóny. Je to preto, že ióny i- Nakoniec oxidujú molekulárny jód, i2. Ak je toho veľa2, Je viac ako pravdepodobné, že sa vytvorí aj anión TriaDuro, i3-, ktoré zafarbí roztok ako hnedé.
Molekulárna hmotnosť
127,91 g/mol.
Vôňa
Aker.
Hustota
Hustota je 1,70 g/ml pre roztok 57%HI; Pretože hustoty sa líšia v závislosti od rôznych koncentrácií HI. Táto koncentrácia tvorí azeotropickú (je destilovaná ako jedna látka a nie ako zmes), ktorej relatívna stabilita môže byť dlžná jej komercializácia nad inými roztokmi.
Bod varu
57% Hi Azeotrop vrie pri 127 ° C pri tlaku 1,03 baru (priechod do bankomatu).
Pka
-1,78.
Kyslosť
Je to mimoriadne silná kyselina, natoľko, že je korozívna pre všetky kovy a tkanivá; Dokonca aj pre gumy.
Je to preto, že spojenie H-I je veľmi slabé a počas svojej vodnej ionizácie sa ľahko rozbije. Okrem toho vodíkové mosty i- - Hanba2+ Sú slabí, takže nie je nič, čo by zasahoval do h3Ani+ reagovať s ostatnými zlúčeninami; to znamená, h3Ani+ má „zadarmo“, ako i- To príliš nepriťahuje do jeho protiiónu.
Môže vám slúžiť: pycnometerRedukčné činidlo
HI je silné redukčné činidlo, ktorého hlavným reakčným produktom je ja2.
Menovanie
Nomenklatúra kyseliny iahydrovej odvodzuje zo skutočnosti, že jód „pracuje“ s jediným oxidačným stavom: -1. A navyše názov naznačuje, že má vodu v rámci svojho štrukturálneho vzorca [i-] [H3Ani+]. Toto je jeho jediné meno, pretože nejde o čistú zlúčeninu, ale riešenie.
Žiadosti
Zdroj jódu v organickej a anorganickej syntéze
HI je vynikajúci zdroj iónov i- pre anorganickú a organickú syntézu a je tiež silným redukčným činidlom. Napríklad jeho 57% vodné rozpustenie sa používa na syntézu alkyl jodidov (napríklad Cho3Chvály2I) z primárnych alkoholov. Podobne môže skupina OH nahradiť v štruktúre i.
Redukčné činidlo
Kyselina yodhydrová sa používa na zníženie napríklad uhľohydrátov. Ak je glukóza rozpustená v tejto kyseline zahrievaná, stratí všetky svoje OH skupiny a získa ako produkt uhľovodík N-hexán.
Podobne sa používa na zníženie funkčných skupín grafénových listov, aby sa dali funkcionalizovať pre elektronické zariadenia.
Cativa
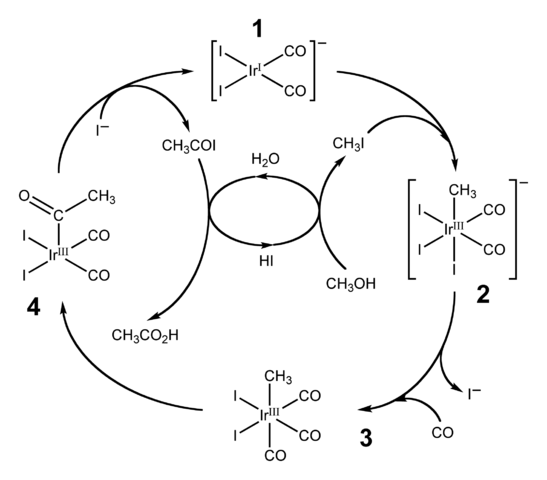 Schéma katalytického cyklu pre proces Cativa. Zdroj: Ben Mills [doména verejnej domény].HI sa používa aj na priemyselnú výrobu kyseliny octovej prostredníctvom procesu Cativa. Skladá sa z katalytického cyklu, v ktorom dochádza k karbonilamácii metanolu; to znamená do molekuly ch3OH, karbonylová skupina je zavedená, C = O, na transformáciu na kyselinu Cho3Kohútik.
Schéma katalytického cyklu pre proces Cativa. Zdroj: Ben Mills [doména verejnej domény].HI sa používa aj na priemyselnú výrobu kyseliny octovej prostredníctvom procesu Cativa. Skladá sa z katalytického cyklu, v ktorom dochádza k karbonilamácii metanolu; to znamená do molekuly ch3OH, karbonylová skupina je zavedená, C = O, na transformáciu na kyselinu Cho3Kohútik.
Kroky
Proces začína (1) komplexom Organo-Iridium [IR (CO)2Jo2]-, štvorcovej plochej geometrie. Táto zlúčenina „prijíma“ metyljodid, ch3I, produkt okyslenosti Cho3Ach s 57% ahoj. Voda sa tiež vyskytuje v tejto reakcii a vďaka nej sa na konci získava kyselina octová, pričom sa HI umožňuje zotaviť sa v poslednom kroku.
Môže ti slúžiť: koloidV tomto kroku obidve skupiny -ch3 Keď sa -i pripojí k kovovému centru Ididio (2), vytvorenie oktaedrálneho komplexu s aspektom zloženou z troch ligandov a. Jeden z Yodos končí nahradením molekuly oxidu uhoľnatého, CO; A teraz (3), oktaedrický komplex má aspekt zloženú z troch ligandov.
Potom dôjde k usporiadaniu: skupina -ch3 Je „prepustený“ z IR a pripojí sa k susednému (4), aby vytvoril acetylovú skupinu -coch3. Táto skupina je prepustená z komplexu Iridido na odkazy na jodidové ióny a dáva Cho3COI, acetyl jodid. Tu je katalyzátor Iridium obnovený, pripravený zúčastniť sa na inom katalytickom cykle.
Nakoniec, Cho3COI trpí nahradením i- Pre molekulu H2Alebo, ktorého mechanizmus končí uvoľnením HI a kyseliny octovej.
Nezákonná syntéza
 Reakcia redukcie efedrínu s červenou fosforickou a fosfore na metaphetamín. Zdroj: metamfetamín_from_ephedrine_with_hi_ru.SVG: odvodený Ring0 Trabajo: MaterialScientist (Speaking) [Public Domain].Kyselina yodhydrová sa používa na syntézu psychotropnej látky, ktorá využíva svoju vysokú redukčnú silu. Napríklad môžete redukovať efedrín (liek na liečbu astmy) v prítomnosti červeného fosforu, na metamfetamín (vynikajúci obraz).
Reakcia redukcie efedrínu s červenou fosforickou a fosfore na metaphetamín. Zdroj: metamfetamín_from_ephedrine_with_hi_ru.SVG: odvodený Ring0 Trabajo: MaterialScientist (Speaking) [Public Domain].Kyselina yodhydrová sa používa na syntézu psychotropnej látky, ktorá využíva svoju vysokú redukčnú silu. Napríklad môžete redukovať efedrín (liek na liečbu astmy) v prítomnosti červeného fosforu, na metamfetamín (vynikajúci obraz).
Je zrejmé, že nahradenie skupiny OH I., po ktorej nasleduje druhá náhrada za H.
Odkazy
- Wikipedia. (2019). Kyselina hydroiodová. Zdroj: In.Wikipedia.orgán
- Andrews, Natalie. (24. apríla 2017). Použitie kyseliny hydriodovej. Vedecký. Obnovené z: vedeckých.com
- Alfa Aesar, Thermo Fisher Scientific. (2019). Kyselina hydriodová. Získané z: Alfa.com
- Národné centrum pre biotechnologické informácie. (2019). Kyselina hydriodová. Databáza pubchem., CID = 24841. Získané z: pubchem.Ncbi.NLM.NIH.Vláda
- Steven a. Hardinger. (2017). Ilustrovaný glosár organickej chémie: kyselina hydroiodová. Získané z: Chem.UCLA.Edu
- Reusch William. (5. mája 2013). Uhľohydráty. Získané z: 2.Chémia.MSU.Edu
- V Kyu Moon, Junghyun Lee, Rodney S. Ruoff & Hyoyoung Lee. (2010). Sčervenaný oxid trafénu chemickou grafitizáciou. Doi: 10.1038/ncomms1067.
- « Memoristické výučbové charakteristiky, typy a príklady
- Charakteristiky bioprocesov, typy, výhody a etapy »

