Štruktúra kyseliny sulfájovej, vlastnosti, syntéza, použitie
- 1676
- 196
- Gabriel Bahna
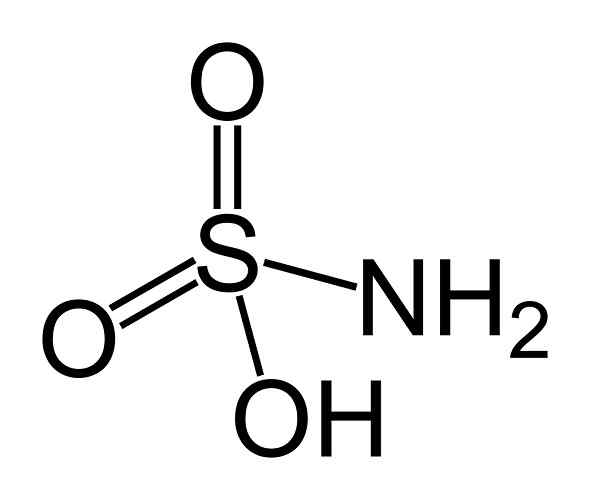
On kyselina Je to anorganická zlúčenina tvorená atómom síry (S) pripojených v kovalentnej forme a jednoduchým odkazom s hydroxylovou skupinou (-OH) a aminoskupinou (-NH (-NH2) a dvojitou väzbou na dva atómy kyslíka (O). Je to biela kryštalická tuhá látka. Jeho chemický vzorec je NH2SW3H. Je tiež známa ako kyselina aminosulfónová, kyselina amidosulfónová, kyselina amidosulfurová a kyselina sulfamidová kyselina.
Kyselina sulfáová je silná kyselina. Môžete reagovať s kovmi, kovmi a oxidmi uhličitanu. Jeho soli sú vo všeobecnosti rozpustné vo vode, takže je dobrým odstraňovačom inlays v procesných zariadeniach. Často sa používa v cukrových mlynoch na čistenie uhličitanových vložiek v výparoch.
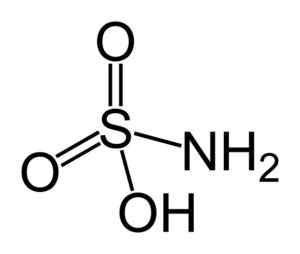 Štruktúra kyseliny sulfámiky. Benjah-Bmm27 [verejná doména]. Zdroj: Wikipedia Commons.
Štruktúra kyseliny sulfámiky. Benjah-Bmm27 [verejná doména]. Zdroj: Wikipedia Commons. Kyselina sulfáová je redukcia dusitanov (nie2-) a táto chemická vlastnosť sa používa v niekoľkých aplikáciách, ako v priemysle farbiva a analýze dusičnanov.
Použije sa v opaľovaní kože a pri bielení buničiny na výrobu papiera. V skutočnosti je to kontaminant jedla, pretože sa často vyskytuje v papieroch a kartách, ktoré sa používajú na zabalenie obchodov s potravinami.
Používa sa tiež v kovovej elektróde ako laboratórny vzor a jeden z jej derivátov je veľmi účinný herbicíd.
[TOC]
Štruktúra
Kyselina kyselina sulfamová kryštalizuje vo forme kryštálov bipiramidálnych ortorrombusov. Vytvárajte kompaktné hranoly a listy, keď kryštalizuje z chladného roztoku, ako aj listy kosoštvorcov, keď z neho robí horúci vodný roztok.
Menovanie
- Kyselina
- Kyselina aminosulfónová
- Kyselina amidosulfónová
- Kyselina amidosulfurová
- Sulfami
Vlastnosti
Fyzický stav
Biela kryštalická pevná látka.
Molekulová hmotnosť
97,1 g/mol.
Bod topenia
205 ° C, rozkladá sa pri 209 ° C.
Hustota
2,15 g/cm3
Rozpustnosť
Rozpustné vo vode:
- 12,8% až 0 ° C
- 17,57% pri 20 ° C
- 22,77% pri 40 ° C
Sotva rozpustné v metanole, mierne rozpustné v acetóne, nerozpustné v éteri.
Voľne rozpustné v dusíkových bázach a organických rozpúšťadlách obsahujúcich dusík.
Nerozpustný pri disulfidu uhlíka (CS2) a tetrachlorid uhlíka (CCL4).
pH
0,41 (v roztoku 1 N, to znamená 1 ekvivalent/l).
Disociačná konštanta
0,101 až 25 ° C.
Chemické vlastnosti
Je to silná kyselina. Takmer rovnako ako kyseliny chlorovodíkovej (HCl), dusičnany3) a sulfuric (h2SW4).
Môže vám slúžiť: okysličené zlúčeniny: vlastnosti, reakcie, použitieVodné roztoky kyseliny sulfámovej sú vysoko ionizované. Jeho pH je nižšie ako roztoky formín, fosforečných a kyselín oxalovej.
Vo vode kyselina sulfamová stráca iba protón, ktorý je viazaný na kyslík. Hydrogény spojené s dusíkmi zostávajú pevne zjednotené.
Vo vodnom roztoku sa pomaly hydrolyzuje, aby sa dal síran kyseliny amónnej (NH4HSO4). Je stabilný v suchých podmienkach.
Kyselina kyselina sulfáová útočí na kovy, oxidy kovov a uhličitany na generovanie sulfamátov. Napríklad s sulfamátom draselného draselného kovu (K) (Koso2NH2) a vodík (h2).
Všetky soli kyseliny sulfámovej sú rozpustné vo vode. Soli vápnika, olova a bária sú vo vode veľmi rozpustné, na rozdiel od zodpovedajúcej kyseliny sírovej.
Kyselina dusná (HNO2) kvantitatívne reagovať s aminoskupinou kyseliny sulfamovej, uvoľňujúc dusík (n2). Odhaduje sa, že sulfamát ión funguje v tejto reakcii ako amida, nie ako amín.
Kyselina sulfáová je oxidovaná chlórom, brómom alebo chloreným draselným, aby sa premenila na kyselinu sírovú. Táto reakcia sa nevyskytuje s inými oxidantmi, ako je kyselina chromová alebo permanganát draselný.
Nie je kompatibilný (reaguje) so silnou alkalis, chlór, kyselinu hypoclorous, hypochlórity, kyanidy a sulfidy.
Ďalšie vlastnosti
Nie je hygroskopický (to znamená, že neabsorbuje vlhkosť vzduchu).
Keď sa zahrieva, až kým rozklad emituje vysoko toxické výpary oxidov síry a chloridu vodíka (HCI).
Jedným z jeho derivátov, sulfamát amónneho, je spomalenie horenia.
Je to mierne toxické.
Syntéza
Kyselina sulfáová sa získava reakciou močoviny (NH2)2 S kyselinou fajčiarskou kyselinou sírovou, to znamená kyselina sírová (H2SW4) koncentrát obsahujúci trikxid siričitý (SO3).
Môže sa tiež syntetizovať reakciou kyseliny chlórsulfónovej (HCLO3Cl) a amoniak (NH3).
Žiadosti
V priemysle sfarbenia
Kyselina sulfáová sa používa na rýchle a efektívne odstránenie nadbytočných dusitanov pri diazotizačných reakciách pri syntéze sfarbenia. Na tento účel je to oveľa praktickejšie ako močovina.
V koženom spracovaní
Počas opaľovania kože poskytuje použitie kyseliny sulfámovej namiesto kyseliny sírovej tenšie a hodvábnejšiu textúru.
Môže vám slúžiť: kovové minerályOkrem toho, pretože sulfamát vápenatého je rozpustný vo vode, na rozdiel od síranu vápenatého sa môže kyselina sírová v rozčarovanom procese použiť bez toho, aby zanechala škvrny, ktoré sa niekedy vyskytujú v koži pri použití kyseliny sírovej.
 Kožená obuv. Zdroj: Pixabay.
Kožená obuv. Zdroj: Pixabay. V čistiacich procesných zariadeniach
Kyselina sulfáová sa používa ako čistič decalcifátora vo varoch, reaktoroch, potrubiach, chladiacich systémoch a výmenníkoch tepla.
V týchto vybavenia.
Vložky alebo tuhé ložiská môžu byť organické (riasy, bahno, huby) alebo anorganické (oxidy železa, sulfidy železa, uhličitany vápnika alebo horečnatého, sulfáty, fosfáty alebo kremičitany).
Kyselina sulfáma je veľmi účinná, keď sa používa na odstránenie inlays uhličitanu vápenatého. Môže sa použiť v medených zariadeniach, mosadze, nehrdzavejúcej oceli, liatine a galvanizovanej oceli.
Používa sa v 5-10% roztoku podľa hmotnosti. Používa sa najmä v cukrových mlynoch na čistenie výparníkov vyrobených z liatiny s medenými výmenníkmi tepla.
 Tím výparníka v cukrovom mlyne. Autor: Antiksh Kumar. Zdroj: Pixabay
Tím výparníka v cukrovom mlyne. Autor: Antiksh Kumar. Zdroj: Pixabay Mal by sa používať pri teplotách nie väčších ako 50-60 ° C. Teploty 70 ° C vedú k tvorbe nerozpustných síranov, ako je prípad4.
Pri použití kombinovaného s chloridom sodným sa vyskytuje synergický efekt a roztok umožňuje oxid železitý pomaly rozpúšťať sa. V tomto prípade by sa nemala používať s nehrdzavejúcou oceľou, pretože sa uvoľňuje kyselina chlorovodíková, čo môže spôsobiť koróziu v tomto materiáli.
V kovovej rafinácii
Elektrodepozícia kovu, ako je meď, striebro, kobalt, nikel, zinok, kadmium, železo a olova. To sa dá zvládnuť oveľa jednoduchšie ako kyselina hydrofovateľná kyselina (h2SIF6).
Ako vzorové činidlo v laboratóriu
Vzhľadom na určité charakteristiky kyseliny sulfámovej, ako je: jej sila ako kyselina, jej ľahkosť sa čistí rekryštalizáciou vo vode, jej stabilita a jej hydroskopicity, sa používa ako primárny štandard na laboratórnej úrovni. To znamená, že sa používa na kvantitatívne stanovenia alkalis.
 Laboratórium. Publikácie. Zdroj: Pixabay
Laboratórium. Publikácie. Zdroj: Pixabay V analýze dusitanov
Kvôli svojej ľahkej reakcii s dusitanmi sa kyselina sulfáová používa na ich stanovenie v roztoku.
Môže vám slúžiť: kyselina triclooctová: štruktúra, vlastnosti, syntéza, použitie, efektyV analýze vody rozpustená vo vode
Pretože reagujúca kyselina síra s dusičnanmi sa uvoľňuje dusík, je možné určiť kyslík rozpustený vo vode, pretože interferencia spôsobená dusitanmi sa eliminuje.
V príprave oxidu dusného
Kyselina sulfáová reaguje s kyselinou dusičnou generujúcou oxid dusný (n2Buď). Táto reakcia je bezpečnejšia ako dusičnan amónny, aby sa získal uvedený plyn.
V poľnohospodárstve
Derivát kyseliny sírovej, sulfamát amónny, je ne -toxický herbicíd pre zvieratá.
Aplikuje rosu na listoch druhov, aby sa vylúčila na konci leta alebo na začiatku jesene, najlepšie vo vlhkom počasí. Po presunutí zlúčeniny z listov na korene rastlina zomrie.
 Aplikácia herbicídov Rocío. Autor: Zefe Wu. Zdroj: Pixabay
Aplikácia herbicídov Rocío. Autor: Zefe Wu. Zdroj: Pixabay Ďalšou výhodou tejto zlúčeniny je to, že pôda sa natrvalo nesterilizuje. Niektoré dusík sulfamátu amónneho bude skutočne k dispozícii na zemi pre rast rastlín v budúcej sezóne.
V ohnivých tkaninách
Jeho kompatibilita s celulózou a jej charakteristikou spomaľovača horenia premieňajte sulfamát amónneho na činidlo, aby sa získali tkaniny a papier rezistentné na oheň.
Používa sa 10% hmotnosti tkaniny, ktorej vzhľad a dotykový pocit zostáva nezmenený. Tkanina, keď sa používa, by sa mala premyť suchom, nikdy sa neumývajte vodou, aby sa nerozpustila s sulfamátom.
Je to užitočné najmä v divadlách alebo podobných miestach.
 Divadlo. Autor: Mustangjoe Zdroj: Pixabay
Divadlo. Autor: Mustangjoe Zdroj: Pixabay V rôznych aplikáciách
Používa sa ako katalyzátor v niektorých chemických reakciách, ako pri príprave živicových živicí močoviny. Je tiež užitočný ako baktericíd a stabilizátor chlóru v bazénoch a ako drevené bielidlo buničiny v továrňach na buničinu a papier.
Odkazy
- Alebo.Siež. Lekárska knižnica. (2019). Kyselina. Obnovený z pubchem.Ncbi.NLM.NIH.Vláda
- Williams, D.L.H. (2004) Nitrozácia v dusíkových centrách. V nitrozačných reakciách a chémii oxidu dusnatého. Kapitola 2. Zotavené z vedeckých pracovníkov.com
- Clapp, Leallyn B. (1943). Kyselina sulfámová a jej použitia. Chem. Pedagóg. 1943, 20, 4, 189. Získané z krčiem.ACS.orgán
- McDonald, James. (2003). Kyselina. Zotavené z VeoliawaterTech.com
- Sastri, V.Siež. (2010). Riadenie a kontrola korózie. V Shreirovej korózii. Zotavené z vedeckých pracovníkov.com
- Bajpai pratima. (2018). Rôzne témy. V Biermannovej príručke buničiny a papiera. Tretia edícia. Zotavené z vedeckých pracovníkov.com
- « Charakteristiky akútnych zvukov a príklady
- Štruktúra monokatériového vírusu, replikácia, dôležitosť »

