Kyselina selenhydrová (H2SE) Čo je, štruktúra, vlastnosti, používa
- 2289
- 665
- Gabriel Bahna
 Vodík seleniuro: dve molekuly vodíka a jeden z selénu
Vodík seleniuro: dve molekuly vodíka a jeden z selénu Čo je kyselina selenhydrová?
On Kyselina o Vodík seleniuro je anorganická zlúčenina, ktorej chemický vzorec je H2On. Má kovalentnú povahu a pri bežných podmienkach teploty a tlaku je to bezfarebný plyn; Ale so silnou rozpoznateľnou vôňou jeho menšej prítomnosti. Chemicky je to trakcia, takže selén má valenciu -2 (i2-).
Zo všetkých seleniur, h2Je to najtoxickejší, pretože jej molekula je malá a jeho atóm selénu má pri reagovaní menej stérických prekážok. Na druhej strane, jej vôňa umožňuje tým, ktorí s ním pracujú, aby ju odhalili v konaní v prípade vonkajšieho laboratórneho zvončeka.
Vodík seleniuro sa môže syntetizovať priamou kombináciou svojich dvoch prvkov: molekulárny vodík, h2, a kovový selén. Môže sa tiež získať rozpustením zlúčenín bohatých na selén, ako je železo seleniuro (II), Fese, v kyseline chlorovodíkovej.
Na druhej strane sa kyselina selenhydrová pripravuje rozpustením vodíka seleniuro vo vode; To znamená, že prvý je rozpustený vo vode, zatiaľ čo druhý pozostáva z nealkoholických nápojov.
Jeho hlavné použitie je zdroj selénu v organickej a anorganickej syntéze.
Vodík seleniuro
 Molekula vodíka. Wikimedia Commons.
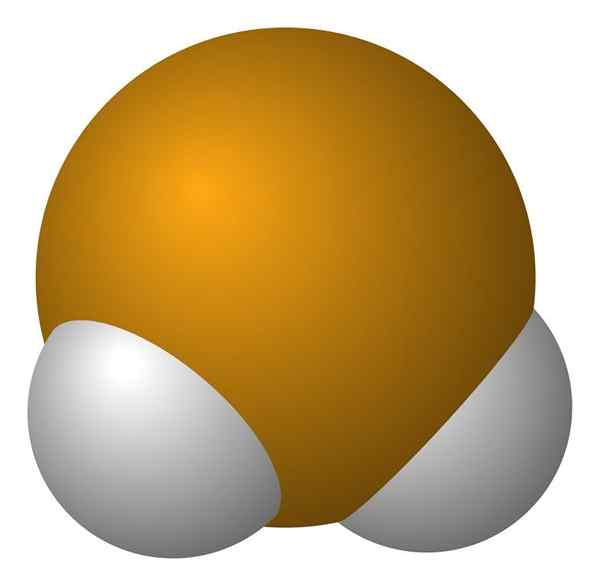
Molekula vodíka. Wikimedia Commons. H molekula2Je z uhlovej geometrie, hoci jeho uhol 91 ° robí z neho vyzerať skôr ako L ako v. V tomto modeli guľôčok a tyčí sú atómy vodíka a selén biele a žlté gule.
Táto molekula, ako je to znázornené, je tá, ktorá je v plynnej fáze; to znamená pre vodík seleniuro. Pri rozpustení vo vode uvoľňuje protón a v roztoku máte pár HSE- H3Ani+; Tento iónový krútiaci moment prichádza do kyseliny selenhydrovej, označenej ako H2Se (ac) na jeho odlíšenie od vodíka seleniuro, h2SE (G).
Môže vám slúžiť: metylénová modrá: Charakteristiky, príprava, použitia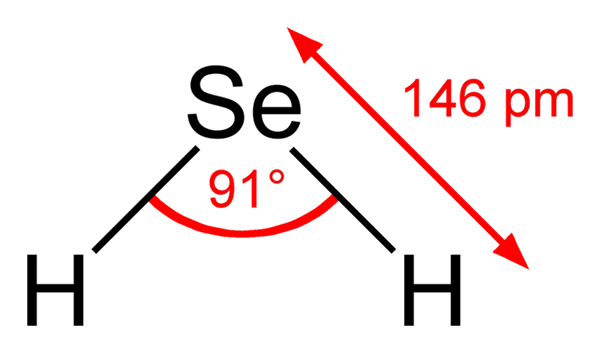 Štrukturálny vzorec kyseliny seleenhydrovej. Ben Mills, Wikimedia Commons ..
Štrukturálny vzorec kyseliny seleenhydrovej. Ben Mills, Wikimedia Commons .. Preto štruktúry medzi h2Se (ac) a h2SE (G) sú veľmi odlišné; Prvý je obklopený vodnou guľou a má iónové zaťaženie a druhý pozostáva z aglomerátu molekúl plynovej fázy.
H molekuly2Sotva môžu navzájom interagovať prostredníctvom veľmi slabých síl dipbolo-dipolo. Selén, hoci je menej elektronegatívny ako síra koncentruje väčšiu elektronickú hustotu, aby „ju vytrhol“ z atómov vodíka.
SELENIO HYDRUES komprimované
Ak h molekuly2Podliehajú mimoriadnemu tlaku (stovky GPA), teoreticky sú nútené upevniť sa vytvorením odkazov SE-H-S; Toto sú prepojenia troch centier a dvoch elektrónov (3C-2E), na ktorých sa podieľa vodík. Preto molekuly začínajú tvoriť polymérne štruktúry, ktoré definujú pevnú látku.
Za týchto podmienok je možné obohatiť tuhé látky s viac vodíkom, čo úplne upravuje výsledné štruktúry. Okrem toho sa zloženie stáva typom HnSE, kde N sa pohybuje od 3 do 6. Teda hydridy selénu komprimované týmito tlakami a v prítomnosti vodíka majú chemické vzorce h3Viem h6On.
Odhaduje sa, že tieto hydrory selénu obohatené o vodík majú supravodivé vlastnosti.
Vlastnosti
Fyzický vzhľad
Bezfarebný plyn, ktorý pri nízkych teplotách vonia ako hniloba a zhnité vajcia, ak sa jeho koncentrácia zvýši. Jeho vôňa je horšia a intenzívnejšia ako sulfid vodíka (čo je už dosť nepríjemné). Je to však dobré, pretože pomáha jeho ľahkej detekcii a znižuje predĺžený kontakt alebo riziká vdýchnutia.
Keď horí, vydáva modrý plameň produktu elektronických interakcií v atómoch selénu.
Môže vám slúžiť: oxid síryMolekulárna hmotnosť
80,98 g/mol.
Bod varu
-41 ° C.
Bod topenia
-66 ° C.
Tlak vodnej pary
9,5 atm pri 21 ° C.
Hustota
3 553 g/l.
Pkdo
3,89.
Rozpustnosť
0,70 g/100 ml. To potvrdzuje skutočnosť, že atóm selénu H2S molekulami vody nemôžete tvoriť vodíkové mosty.
Rozpustnosť v iných rozpúšťadlách
-Rozpustný v CS2, čo nie je prekvapujúce chemickou analógiou medzi selénom a síry.
-Rozpustný fosgén (pri nízkych teplotách, keď sa vrie pri 8 ° C).
Menovanie
Ako je vysvetlené v predchádzajúcich častiach, názov tejto zlúčeniny sa líši v závislosti od toho, či h2Je v sóde alebo rozpustenej fáze vo vode. Keď sa nachádza vo vode, hovorí sa o kyseline seleenhydrovej, čo nie je nič iné ako hydracia v anorganických podmienkach. Na rozdiel od molekúl plynu je jeho kyslý charakter väčší.
Atoma seléniu si však buď ako plyn alebo rozpustený vo vode, zachováva rovnaké elektronické vlastnosti; Napríklad jej Valencia je -2, pokiaľ netrpíte oxidačnou reakciou. Táto Valencia z -2 je dôvod, prečo sa nazýva seleniaurochy vodíka, pretože seleniuro anión je2-; ktorý je reaktívnejší a redukčný ako S2-, sulfid.
Ak sa použije systematická nomenklatúra, musí sa špecifikovať počet atómov vodíka v zlúčenine. Teda h2Volá sa: seleniuro z dalvodík.
Seleniuro alebo hydrid?
Niektoré zdroje ho označujú ako hydrid. Keby to naozaj bolo, selén by mal kladný náboj +2 a vodíkové záporné zaťaženie -1: seh2 (On2+, H-). Selén je viac elektronegatívny atóm ako vodík, a preto končí „monopolizáciu“ najvyššej elektronickej hustoty v molekule H2On.
Môže vám slúžiť: termochémiaAko také však nemožno vyradiť existenciu hydridu selénu. V skutočnosti s prítomnosťou H aniónov- Uľahčilo by to odkazy na SE-H-SE, zodpovedné za pevné štruktúry vytvorené s obrovskými tlakmi podľa počítačových štúdií.
Žiadosti
Metabolický
Aj keď sa to zdá byť protichodné, napriek veľkej toxicite H2SE, vyrába sa v tele na metabolickej trase selénu. Bunky sa však sotva vyrábajú ako sprostredkovateľ v syntizácii selenioproteínov alebo sa končia metylované a vylučované; Jedným zo symptómov tohto je cesnaková chuť v ústach.
Priemyselný pracovník
H2Používa sa hlavne na pridávanie atómov selénu do tuhých štruktúr, ako sú polovodičové materiály; do organických molekúl, ako sú alkény a nitrily na syntézu organických seleniur; alebo do roztoku na zrážanie kovových seleniur.
Odkazy
- Vodíkový selenid. Zdroj: In.Wikipedia.orgán
- Vodíkový selenid, h2On. Získané z: selénu.Atóm.com

