Kyselina píchrová, čo je, štruktúra, syntéza, vlastnosti
- 1104
- 239
- Tomáš Klapka
On Kyselina Je to vysoko nitrado organická chemická zlúčenina, ktorej názov IUPAC je 2,4,6-trinitrofenol. Jeho molekulárny vzorec je C6H2(Nie2)3Oh. Je to veľmi kyslý fenol a možno ho nájsť ako pikrát sodný, amónny alebo draslík; to znamená, že vo svojej iónovej forme C6H2(Nie2)3Zboj.
Je to tuhá silná chuť horkej a odtiaľ odvodzuje svoje meno, z gréckeho slova „prikos“, čo znamená horké. Nachádza sa ako vlhké žlté kryštály. Jeho vysušenie alebo dehydratácia je nebezpečná, pretože zvyšuje nestabilné vlastnosti, ktoré ho robia výbušným.
Kyselina pích, používa sa ako základ pre syntézu trvalých farbív žltého tónu. Niektorí patológovia a vedci ho používajú pri fixácii alebo zafarbení tkanivových sekcií a iných imunohistochemických procesov.
Je to veľmi užitočné pri vývoji farmaceutických výrobkov. Okrem toho sa používa pri vypracovaní zápasov alebo zápasov a výbušnín. Používa sa tiež na zaznamenávanie kovov, na výrobu farebného skla a pri kolorimetrickom stanovení biologických parametrov, ako je kreatinín.
Štruktúra
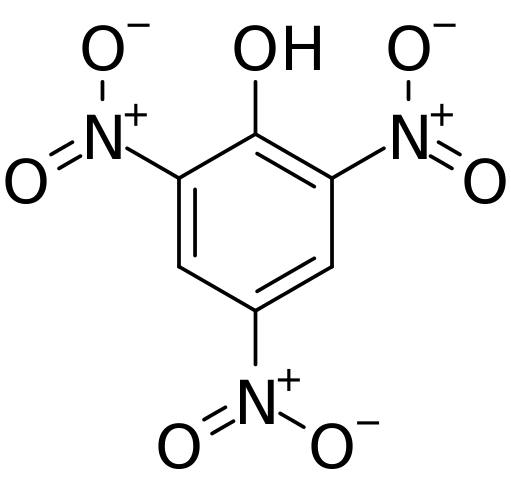
 Štruktúra a formálne zaťaženie v kyseline pychorickej. Zdroj: CVF-PS [verejná doména]
Štruktúra a formálne zaťaženie v kyseline pychorickej. Zdroj: CVF-PS [verejná doména] Na hornom obrázku sú všetky väzby a štruktúra samy o sebe molekuly kyseliny pích, znázornené podrobnejšie. Pozostáva z fenolu s tromi nitro substituentmi.
Je zrejmé, že v skupinách nie2 Atóm dusíka má pozitívne čiastočné zaťaženie, a preto dopyt po elektronickej hustote zo svojho okolia. Ale aromatický krúžok tiež priťahuje elektróny k sebe a pred tromi nie2 nakoniec dáva časť svojej vlastnej elektronickej hustoty.
V dôsledku toho je kyslík OH skupiny tendenciu zdieľať jedného zo svojich voľných elektronických kolegov, aby dodával elektronický nedostatok, ktorý utrpel kruh; A pritom sa vytvorí odkaz C = o+-H. Táto pozitívna čiastočná záťaž v kyslíku oslabuje väzbu O-H a zvyšuje sa kyslosť; to znamená, že sa uvoľní ako vodíkový ión, h+.
Kyslý fenol
Z tohto dôvodu je táto zlúčenina mimoriadne silná kyselina (a činidlo), dokonca viac ako samotná kyselina octová. Zlúčenina je však skutočne fenolom, ktorého kyslosť prevyšuje aaktivitu ostatných fenolov; ako už spomenuli, substituenti nie2.
Môže vám slúžiť: termodynamické procesyPreto, pretože ide o fenol, skupina OH má prioritu a riadi vymenovanie v štruktúre. Traja nie2 Nachádzajú sa v uhlíkoch 2, 4 a 6 aromatického kruhu vzhľadom na OH. Odtiaľ odvodí nomenklatúru IUPAC pre túto zlúčeninu: 2,4,6-trinitrofenol (TNP).
Keby skupiny neboli2, Alebo ak by v kruhu bolo menšie množstvo, odkaz O-H by menej oslabil, a preto by zlúčenina mala menšiu kyslosť.
Kryštalická štruktúra
Molekuly kyseliny pycrovej sa usporiadajú tak, aby uprednostňovali svoje intermolekulárne interakcie; buď na tvorbu vodíkových mostov medzi skupinami OH a nie2, Dipolo-Dippolo sily alebo elektrostatické odpory medzi zlými elektrónovými regiónmi.
Dalo by sa očakávať, že skupiny nie2 Odrazujú sa navzájom a vedenie smerom k susedným aromatickým krúžkom. Podobne by krúžky nemohli zarovnať jeden na seba kvôli zvýšeniu elektrostatických odporov.
V dôsledku všetkých týchto interakcií sa kyselina píchrová podarí vytvoriť trojrozmernú sieť, ktorá definuje kryštál; ktorého jednotková bunka zodpovedá kryštalickému systému ortorrombického typu.
Syntéza
Spočiatku bol syntetizovaný z prírodných zlúčenín, ako sú deriváty živočíšnych rohov, prírodné živice,. Od roku 1841 sa fenol používa ako predchodca kyseliny pikrovej, po niekoľkých trasách alebo niekoľkými chemickými postupmi.
Ako už bolo povedané, je to jeden z najkJovnejších fenolov. Na syntézu je najprv požadované, aby fenol utrpel sulfonačný proces, po ktorom nasledoval nitráčný postup.
Sulfonácia bezvodého fenolu sa vykonáva pri liečbe fenolu kyselinou sírovou dymom, ktorá sa vyskytuje aromatické elektrofylické substitúcie h pomocou sulfonátových skupín, takže sa3H, v polohe -orto a -para vzhľadom na skupinu OH.
Tento produkt, kyselina 2,4-pynoldisulfónová, vykonáva sa proces dusičnanu a ošetrí ho koncentrovanou kyselinou dusičnou. Pritom, dve skupiny3H sa nahradia nitro skupinami, nie2, A tretí vstupuje do druhej pozície nitro. Toto ilustruje nasledujúca chemická rovnica:
Môže vám slúžiť: elastické materiály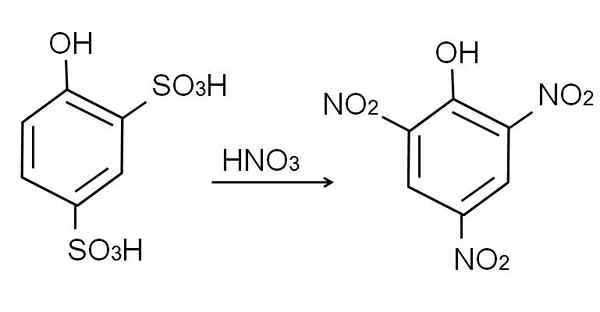 Dusičnanná dusičnany 2,4-fenoldisulfón. Zdroj: Gabriel Bolívar.
Dusičnanná dusičnany 2,4-fenoldisulfón. Zdroj: Gabriel Bolívar. Priama dusičnany fenolu
Nitračný proces fenolu sa nedá priamo vykonávať, pretože sa generujú ciele s vysokou molekulovou hmotnosťou. Táto metóda syntézy si vyžaduje veľmi starostlivú kontrolu teploty, pretože je veľmi exotermická:
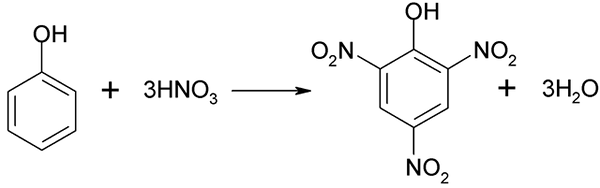 Priama dusičnany fenolu. Zdroj: Akane700 [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)]
Priama dusičnany fenolu. Zdroj: Akane700 [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)] Kyselina pích, je možné získať pri vykonávaní priameho procesu dusičnanu 2,4-dinitrofenol s kyselinou dusičnou.
Ďalšou formou syntézy je ošetrenie benzénu kyselinou dusičnou a dusičnanom ortuťom.
Fyzikálne a chemické vlastnosti
Molekulová hmotnosť
229.104 g/mol.
Fyzický vzhľad
Žltá hmota mokrých kryštálov.
Vôňa
Je to toaleta.
Príchuť
Je to veľmi horké.
Bod topenia
122.5 ° C.
Bod varu
300 ° C. Ale pri topení exploduje.
Hustota
1,77 g/ml.
Rozpustnosť
Je to mierne zlúčenina rozpustná vo vode. Je to preto, že vaše OH skupiny a nie2 Môžu interagovať s molekulami vody pomocou vodíkových mostov; Aj keď je aromatický kruh hydrofóbny, a preto poškodzuje jeho rozpustnosť.
Kričanie
Kyselina pycrová je všeobecne korozívna pre kovy, s výnimkou cínu a hliníka.
Pka
0,38. Je to silná organická kyselina.
Nestabilita
Kyselina pích, charakterizuje sa vlastnením nestabilných vlastností. Predstavuje riziko pre životné prostredie, je nestabilné, výbušné a toxické.
Musí sa uložiť dobre zatvorené, aby sa predišlo dehydratácii, pretože kyselina pikrová je veľmi výbušná, ak sa nechá vyschnúť. Musíte byť veľmi opatrní s jeho bezvodým tvarom, pretože je veľmi citlivý na trenie, údery a teplo.
Pychrálna kyselina by sa mala skladovať vo vetraných čerstvých miestach, ďaleko od oxiditeľných materiálov. Je dráždivé kontaktovať s kožou a sliznicami, nemalo by sa poživiť a pre telo je toxický.
Žiadosti
Kyselina pích, vo všeobecnosti sa používa v oblasti výskumu, v chémii, v priemysle a vo vojenskej oblasti.
Vyšetrovanie
Ak sa používa ako fixačný prostriedok na bunku a tkanivo, zlepšuje výsledky farieb s kyslými farbivami. Stáva sa to s trichromickými metódami sfarbenia. Po nastavení tkaniny formalínom sa odporúča nová fixácia s kyselinou píchrou.
Môže vám slúžiť: Stlačte filter: Charakteristiky, časti, ako to funguje, používaTýmto spôsobom je zaručené intenzívne a veľmi jasné sfarbenie tkanív. Dobré výsledky sa získavajú so základnými farbivami. Preventívne opatrenia však musia.
Organická chémia
-V organickej chémii sa používa ako alkalické pikraty na identifikáciu a analýzu rôznych látok.
-Sa používa v kovovej analytickej chémii.
-V klinických laboratóriách sa používa pri určovaní séra a hladiny kreatinínu moču.
-Používa sa tiež v niektorých činidlách použitých na analýzu hladín glukózy.
V priemysle
-Na úrovni fotografického priemyslu sa kyselina píchrová používa ako senzibilizátor vo fotografických emulziách. Bol súčasťou vypracovania výrobkov, ako sú pesticídy, silné insekticídy.
-Kyselina píchrová sa používa na syntézu iných stredných chemických zlúčenín, ako je napríklad chloropikrín a pikramická kyselina. Z týchto zlúčenín boli vyvinuté niektoré lieky a farbivá pre kožený priemysel.
-Kyselina píchrová sa použila pri liečbe popálenín, ako sú antiseptické a iné podmienky, predtým, ako sa preukázala jej toxicita.
-Dôležitá zložka podľa jeho výbušného charakteru pri rozpracovaní zápasov a batérií.
Vojenské aplikácie
-Vzhľadom na vysokú výbušnosť kyseliny píchrovej sa používa vo vojenských zbraňových závodoch.
-Kyselina píchrová bola lisovaná a obsadená v delostreleckých projektiloch, čerpadlách a baniach.
-Amónna soľ kyseliny pycrovej sa používa ako výbušnina, je veľmi silná, ale menšia stabilita ako TNT. Na nejaký čas sa použil ako zložka raketového paliva.
Toxicita
Dokázalo sa, že je veľmi toxický pre ľudský organizmus a všeobecne pre všetky živé bytosti.
Odporúča sa vyhnúť inhalácii a požitiu, za akútnu orálnu toxicitu. Spôsobuje tiež mutáciu v mikroorganizmoch. Predstavuje toxické účinky na voľne žijúce zvieratá, na cicavce a všeobecne v prostredí.
Odkazy
- Carey F. (2008). Organická chémia. (Šieste vydanie). MC Graw Hill.
- Purdue University. (2004). Výbuch kyseliny pikrovej. Zdroj: Chemed.Chem.Purdue.Edu
- « Biografia, teória a ďalšie príspevky Patricia Benner
- Maguey Čo je, vlastnosti, biotop, reprodukcia »

